
【題目】含有氨基(—NH2)的化合物通常能夠與鹽酸反應,生成鹽酸鹽,如:R—NH2+HCl―→R—NH2·HCl(R代表烷基、苯環等)。
現有兩種化合物A和B,它們互為同分異構體。已知:
①它們都是對位二取代苯;
②它們的相對分子質量都是137;
③A既能被NaOH溶液中和,又可以跟鹽酸成鹽,但不能與FeCl3溶液發生顯色反應;B既不能被NaOH溶液中和,也不能跟鹽酸成鹽;
④它們的組成元素只可能是C、H、O、N、Cl中的幾種。
請按要求填空:
(1)A和B的分子式是________________。
(2)A的結構簡式是_____________________________;
B的結構簡式是______________________________________。
科目:高中化學 來源: 題型:
【題目】通過對煤的綜合利用,可以獲得多種有機物。化合物A含有碳、氫、氧3種元素,其質量比是12:3:8。液態烴B是一種重要的化工原料,其摩爾質量為78 gmol-1。E是有芳香氣味的酯。它們之間的轉化關系如下(含有相同官能團的有機物通常具有相似的化學性質):
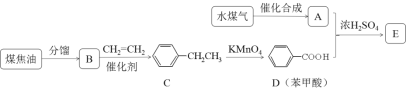
請回答:
(1)化合物A所含的官能團名稱是_____________。
(2)B和CH2=CH2反應生成C的反應類型是_____________。
(3)E在氫氧化鈉溶液中水解的化學方程式是_____________。
(4)下列說法正確的是_____________。
A.將銅絲在空氣中灼燒后迅速插入A中,反應多次,可得到能發生銀鏡反應的物質
B.在一定條件下,C可通過取代反應轉化為![]()
C.苯甲酸鈉(常用作防腐劑)可通過D和氫氧化鈉反應得到
D.共a mol的B 和D混合物在氧氣中完全燃燒,消耗氧氣大于7.5a mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《焦點訪談》欄目中曾報道“鉈中毒事件”,鉈再次成為公眾關注的焦點。已知鉈有兩種天然同位素![]() 和
和![]() 。下列關于
。下列關于![]() 說法正確的是( )
說法正確的是( )
A. 中子數與質子數之差為122B. 中子數與電子數之差為122
C. 質量數與中子數之差為81D. 質量數與電子數之差為81
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.實驗室常用以下幾種方法制取氯氣。
(1)二氧化錳與濃鹽酸反應制氯氣,寫出其反應的離子方程式__________________。
(2)高錳酸鉀與濃鹽酸反應制氯氣,寫出其反應的化學方程式________。
(3)氯酸鉀與濃鹽酸反應制氯氣,該反應中氧化產物與還原產物的物質的量之比為____。
Ⅱ.某研究性學習小組利用下列裝置制備漂白粉,并進行漂白粉有效成分的質量分數的測定。
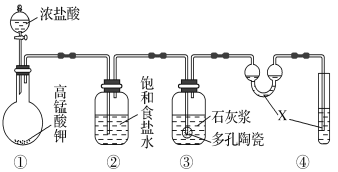
(1)裝置④中的X試劑為_____________________。
(2)裝置③中發生反應的化學方程式為_______________________,
(3)測定漂白粉有效成分的質量分數:稱取1.000 g漂白粉于錐形瓶中,加水溶解,調節溶液的pH,以淀粉為指示劑,用0.100 0 mol·L-1KI溶液進行滴定,溶液出現穩定淺藍色時為滴定終點。反應原理為:
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
實驗測得數據如下表所示。
滴定次數 | 1 | 2 | 3 |
KI溶液體積/mL | 19.98 | 20.02 | 20.00 |
該漂白粉中有效成分的質量分數為________;若滴定過程中未充分振蕩溶液,局部變淺藍色時就停止滴定,則測定結果將________(填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純度晶體硅是典型的無機非金屬材料,又稱“半導體”材料,它的發現和使用曾引起計算機的一場 “革命”。它的制備方法如下圖所示,下列說法正確的是
![]()
A. 步驟①的化學方程式為:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼燒熔融的Na2CO3固體,可用石英坩堝
C. 二氧化硅能與氫氟酸反應,而硅不能與氫氟酸反應
D. SiHCl3(沸點33.0℃)中含有少量SiCl4(沸點67.6℃),可通過蒸餾(或分餾)提純SiHCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組,利用如圖所示裝置探究元素非金屬性強弱的變化規律。
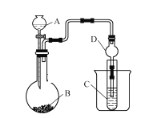
(1)儀器A的名稱為_________,干燥管D的作用是_____。
(2)實驗室中現有藥品Na2S、濃鹽酸、稀硫酸、MnO2,請選擇合適藥品設計實驗探究氯和硫的非金屬性強弱(必要時可以加熱,圖中省略):
①裝置A中所裝藥品為_________。
②裝置C中的實驗現象為:有淡黃色沉淀生成,該裝置中的化學反應方程式為__________。
③根據該實驗探究出的結果,可知HCl的穩定性比H2S的穩定性____。(填“強”或“弱”)
(3)若要探究硫和碳元素的非金屬性強弱,B、C中所裝藥品分別為Na2CO3固體、澄清石灰水,則A中反應的離子方程式為__________,觀察到C裝置中的現象為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅的兩種氧化物在化工生產中都有著重要的用途。
I.CuO可用于制備Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的熱化學方程式為____________________________________。
(2)溫度為T時,向5L恒容密閉容器中加人80g CuO制備Cu2O,5min時恰好達到平衡,測得容器中Cu2O的物質的量為0.4mol。
①該反應的平衡常數K=_____________________。
②5min時縮小容器容積,重新達到平衡時O2的濃度_________(填“增大”“減小”或“不變”)。
③其他條件不變,起始向該容器中充入0.5molCuO,重復實驗,達到平衡的時間_____2.5min(填“大于”“小于”或“等于”);達到平衡時Cu2O的物質的量______0.2mol(填“大于”“小于”或“等于”)。
(3)研究表明,在CuO中加入適量碳粉,下列說法中有利于制得納米級Cu2O的是_____(填選項字母)。
A.碳與氧氣反應放熱,加快反應速率
B.生成CO氣體,使固體顆粒容易分散
C.CO可以將Cu2O還原為銅粉
D.CO作該反應的催化劑
II.CuO可用于冶煉銅(已知:CO的燃燒熱△H=-283kJ/mol),一定條件下,將1molCuO和0.5molCO加人2L密閉容器中發生反應,t1時達到平衡,t2后改變容器中的條件,用CO表示的反應速率(v)與時間(t)的關系如圖所示(三個階段改變的條件為溫度、壓強、濃度中的一個)。
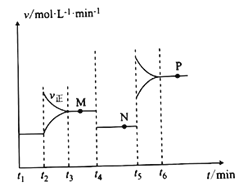
(4)t4時改變的條件為______________________________________________。
(5)M、N、P三點對應狀態下,CO的轉化率a(M)、a(N)、a(P)的大小關系為_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向飽和氯水中逐滴滴入0.1mol·L-1的氫氧化鈉溶液,pH變化如右圖所示,下列有關敘述正確的是( )
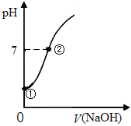
A. ①點所示溶液中只存在HClO的電離平衡
B. ①到②水的電離程度逐漸減小
C. I-能在②點所示溶液中存在
D. ②點所示溶液中:c(Na+)=c(Cl-) + c(ClO-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】端炔烴在催化劑存在下可發生偶聯反應,稱為Glaser反應。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 該反應在研究新型發光材料、超分子化學等方面具有重要價值。下面是利用Glaser反應制備化合物E的一種合成路線:
R-C≡C-C≡C-R+H2, 該反應在研究新型發光材料、超分子化學等方面具有重要價值。下面是利用Glaser反應制備化合物E的一種合成路線:

回答下列問題:
(1)B的結構簡式為________,D的化學名稱為________。
(2)①和③的反應類型分別為________、________。
(3)E的結構簡式為______。用1 mol E合成1,4二苯基丁烷,理論上需要消耗氫氣__ mol。
(4)化合物(![]() )也可發生Glaser偶聯反應生成聚合物,該聚合反應的化學方程式為__________。
)也可發生Glaser偶聯反應生成聚合物,該聚合反應的化學方程式為__________。
(5)芳香化合物F是C的同分異構體,其分子中只有兩種不同化學環境的氫,數目比為3∶1,寫出其中3種的結構簡式_____________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com