
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH飽和溶液,又有CaCO3沉淀生成 | |
| B. | 向Na2CO3溶液中逐滴加入等物質的量的稀鹽酸,生成的CO2與原Na2CO3的物質的量之比為1:2 | |
| C. | 等質量的NaHCO3和Na2CO3分別與足量鹽酸反應,在同溫同壓下,生成的CO2體積前者多 | |
| D. | 向Na2CO3飽和溶液中通CO2,有NaHCO3結晶析出 |
分析 A.含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,生成Ca(HCO3)2,加入NaOH飽和溶液,可生成碳酸鈣沉淀;
B.向Na2CO3溶液中逐滴加入等物質的量的稀鹽酸,生成NaHCO3;
C.NaHCO3的摩爾質量比Na2CO3小,以此計算;
D.向Na2CO3飽和溶液中通CO2,生成溶解度更小的NaHCO3.
解答 解:A.含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,發生CaCO3+CO2+H2O=Ca(HCO3)2,生成Ca(HCO3)2,加入NaOH飽和溶液,可生成碳酸鈣沉淀和碳酸鈉,故A正確;
B.根據化學方程式:Na2CO3+HCl=NaCl+NaHCO3,當碳酸鈉和鹽酸物質的量相等時,不會產生二氧化碳,故B錯誤;
C.NaHCO3和Na2CO3都與鹽酸反應生成二氧化碳氣體:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3的摩爾質量比Na2CO3小,則生成的CO2體積前者多,故C正確;
D.向Na2CO3飽和溶液中通CO2,生成溶解度更小的NaHCO3,可析出NaHCO3晶體,故D正確.
故選B.
點評 本題考查難溶電解質的溶解平衡以及鹽類的水解,側重考查Na2CO3和NaHCO3性質的異同,題目難度不大,注意把握Na2CO3和NaHCO3性質,注重基礎知識的積累.


 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
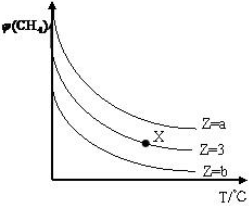 一定條件下,CH4與H2O(g)發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g)設起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒壓下,平衡時CH4的體積分數φ(CH4)與Z和T(溫度)的關系如圖所示,下列說法錯誤的是( )
一定條件下,CH4與H2O(g)發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g)設起始$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=Z,在恒壓下,平衡時CH4的體積分數φ(CH4)與Z和T(溫度)的關系如圖所示,下列說法錯誤的是( )| A. | 該反應的焓變△H>0 | |
| B. | 圖中Z的大小為b>3>a | |
| C. | 圖中X點對應的平衡混合物中$\frac{n({H}_{2}O)}{n(C{H}_{4})}$=3 | |
| D. | 溫度不變時,圖中X點對應的平衡在加壓后φ(CH4)增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 軟水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-純堿法中石灰是指CaCO3 | |
| C. | 石灰-純堿法軟化硬水過程中,Mg2+引起的硬度轉化成了Ca2+的硬度 | |
| D. | 離子交換劑不能再生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
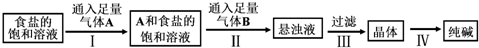
| A. | 氣體A是NH3,氣體B是CO2 | |
| B. | 侯氏制堿法的工藝過程中應用了物質溶解度的差異 | |
| C. | 第III步操作用到的主要玻璃儀器是燒杯、漏斗、玻璃棒 | |
| D. | 第Ⅳ步操作的主要過程有溶解、蒸發、結晶 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgCl在飽和NaCl溶液中的Ksp比在純水中的Ksp小 | |
| B. | 向AgCl的懸濁液中加入NaBr溶液,白色沉淀轉化為淡黃色,說Ksp(AgCl)<Ksp(AgBr) | |
| C. | 將0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先產生Ag2CrO4沉淀 | |
| D. | 向AgCl的懸濁液中滴加濃氨水,沉淀溶解,說明AgCl的溶解平衡向右移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
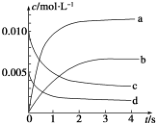 在 2L 容積不變的密閉容器內,800℃時反應 2NO(g)+O2(g)═2NO2(g)體系中,n(NO)隨時間的變化如下表:
在 2L 容積不變的密閉容器內,800℃時反應 2NO(g)+O2(g)═2NO2(g)體系中,n(NO)隨時間的變化如下表:| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com