
| A. | H2(g)的燃燒熱為571.6 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同質量的H2(g)和CH3OH(l)完全燃燒,H2(g)放出的熱量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
分析 A、燃燒熱是1mol可燃物完全燃燒生成穩定氧化物放出的熱量;
B、反應生成硫酸鋇沉淀過程是放熱過程;
C、根據熱化學方程式計算熱量;
D、根據已知熱化學方程式,結合蓋斯定律計算.
解答 解:A.燃燒熱是指1mol純物質完全燃燒生成穩定的氧化物所放出的熱量,所以H2的燃燒熱為$\frac{1}{2}$×571.6 KJ/mol,故A錯誤;
B.中和熱是強酸強堿的稀溶液完全反應生成1mol水時放出的熱量,反應生成硫酸鋇沉淀過程是放熱過程,△H<-57.3 kJ•mol-1,故B錯誤;
C.令H2(g)和CH3OH(l)的質量都為1g,則1g氫氣燃燒放熱為$\frac{1}{2}$×$\frac{1}{2}$×571.6=142.45KJ,1gCH3OH燃燒放熱為$\frac{1}{32}$×$\frac{1}{2}$×1452=22.68KJ,所以H2(g)放出的熱量多,故C正確;
D.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1改寫為3H2(g)+$\frac{3}{2}$O2(g)═3H2O(l)△H=-($\frac{3}{2}$×571.6)kJ•mol-1,
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1改寫為CO2(g)+2H2O(l)=CH3OH(l)+$\frac{3}{2}$O2(g))△H=+($\frac{1}{2}$×1452)kJ•mol-1.
改寫后的方程相加即得3H2(g)+CO2(g)=CH3OH(l)+H2O(l),所以其△H═-($\frac{3}{2}$×571.6)+($\frac{1}{2}$×1452)=-131.4kJ•mol-1.故D錯誤.
故選C.
點評 本題考查了反應燃燒熱、中和熱概念的分析應用,蓋斯定律的應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
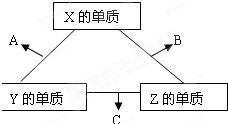
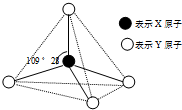 現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.請回答下列問題:
現有A、B、C、D、E、F六種物質或粒子,其中A、B、C、D都具有如圖所示的結構或結構單元,(圖中正四面體以外可能有的部分未畫出,虛線不表示化學鍵或分子間作用力,X、Y可以相同也可以不同).A、B的晶體類型相同.單質A的同素異形體能與B物質發生置換反應.C、D、E、F含有相等的電子數,且D是陽離子,D與F的組成元素相同.C、E、F的晶體類型相同,由E構成的物質常溫下呈液態.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用催化劑可以增大正反應速率,減小逆反應速率 | |
| B. | 使用催化劑可以使化學平衡正向移動 | |
| C. | 使用催化劑可以降低反應的活化能 | |
| D. | 使用催化劑可以改變反應的平衡常數 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 1L某混合溶液,可能含有的離子如下表:
1L某混合溶液,可能含有的離子如下表:| 可能大量含有的陽離子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的陰離子 | Cl-、Br-、I-、ClO-、AlO2- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 步驟序號 | 操作 | 實驗現象 | 判 斷 |
| ① | 取固體溶于水,得溶液X | 得到無色溶液 | |
| ② | 取少量溶液X,加入氯化鋇溶液 | 生成白色沉淀 | 可能含有SO42-、SO32-、CO32- (填離子符號) |
| ③ | 取少量溶液X,加入濃氫氧化鈉溶液,加熱,并在試管口用濕潤的紅色石蕊試紙檢驗 | 試紙變藍 | 含有NH4+ (填離子符號) |
| 結論:此白色固體可能是(NH4)2SO4或(NH4)2SO3或(NH4)2CO3. | |||
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com