
分析 (1)As2S3和SnCl2在鹽酸中反應轉化為As4S4和SnCl4并放出H2S氣體,反應的方程式為2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,可根據方程式或化合價的變化判斷;
(2)根據反應物中某元素化合價的升高來分析還原劑,并利用氣體的性質來分析氣體的吸收,離子反應方程式為:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-;
(3)As2S3和濃HNO3反應生成H3AsO4、S和NO2,所以反應的化學方程式為:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,根據化合價升降用單線橋法表示電子轉移的方向和數目;
(4)后階段生成NO、NO2、N2O4,生成的氣體恰好與11.2L O2(標準狀況)混合后用水吸收全部轉化成濃HNO3,然后與過量的碳在加熱時反應仍生成二氧化氮,相當于一氧化氮和碳失電子給0.5mol的氧氣得電子,利用得失電子守恒來分析解答.
解答 解:(1)根據電子得失守恒知1molAs2S3作氧化劑得到2mol電子,而1molSnCl2作還原劑失去2mol電子,所以二者的物質的量之比是1:1,故答案為:1:1;
(2)反應中SnCl2中的Sn元素化合價升高,SnCl2為還原劑,As2S3作氧化劑,H2S為酸性氣體,可用NaOH溶液吸收,離子反應方程式為:H2S+2OH-=2H2O+S2-、S2-+H2S=2HS-,故答案為:As2S3;NaOH溶液;
(3)As2S3和濃HNO3反應生成H3AsO4、S和NO2,所以反應的化學方程式為:As2S3+10HNO3═2H3AsO4+3S↓+10NO2↑+2H2O,用單線橋法表示電子轉移的方向和數目為: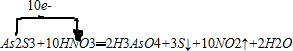 ,若生成2mol H3AsO4,則反應中轉移電子的物質的量為10mol,若將該反應設計成一原電池,在原電池的正極上硝酸根發生得電子的還原反應,產生二氧化氮,則NO2應該在正極附近逸出,故答案為:10mol;正極;
,若生成2mol H3AsO4,則反應中轉移電子的物質的量為10mol,若將該反應設計成一原電池,在原電池的正極上硝酸根發生得電子的還原反應,產生二氧化氮,則NO2應該在正極附近逸出,故答案為:10mol;正極;
(4)后階段生成NO、NO2、N2O4,生成的氣體恰好與11.2L O2(標準狀況)混合后用水吸收全部轉化成濃HNO3,然后與過量的碳在加熱時反應仍生成二氧化氮,相當于一氧化氮和碳失電子給0.5mol的氧氣得電子,利用得失電子守恒,4n(O2)=4n(C)+2n(NO),因為:2n(NO)>0,所以4n(O2)>4n(C),即n(C)<n(O2)=0.5,則產生的CO2的量小于0.5mol,
故選a.
點評 本題考查氧化還原反應、混合物計算等知識,難度中等,側重考查學生的分析思維能力與解題方法技巧,注意利用守恒法進行解答.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
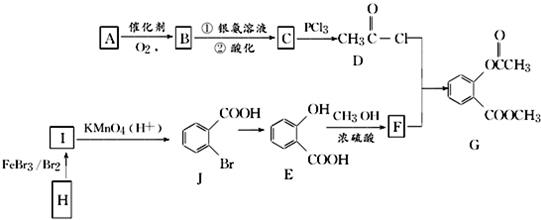
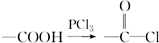
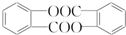 .
.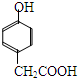 .
.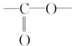 結構
結構查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
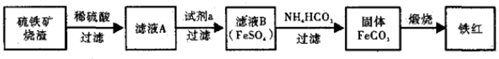
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.7g金屬鋁變成鋁離子時失去的電子數目為0.1NA (提示:M(Al)=27g/mol) | |
| B. | 17g氨氣所含的電子數目為10NA (提示:M(NH3)=17g/mol) | |
| C. | 2g氫氣所含原子數目為NA (提示:M(H2)=2g/mol) | |
| D. | 常溫常壓下,11.2L氮氣所含的原子數目為NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com