
2010年5月15日,CCTV對“南澳一號”沉船的考古進行了兩個小時的現場直播,從沉船中發現了大量宋代精美瓷器,體現了燦爛的中華文明。
青花瓷胎體的原料——高嶺土[Al2Si2O5(OH)x],可摻進瓷石制胎,青花瓷釉料的成分主要是鉀長石(KAlSi3O8),在1300℃左右一次燒成的釉可形成精美的青花瓷。
(1)下列說法正確的是________(填序號)。
A.高嶺土分子中x=2
B.鉀長石能完全溶解在鹽酸中形成澄清的溶液
C.燒制青花瓷過程中發生了復雜的物理變化和化學變化
D.青花瓷、玻璃、水泥都屬于硅酸鹽產品
(2)在“南澳一號”考古直播過程中,需用高純度SiO2制造的光纖。如圖是用海邊的石英砂(含氯化鈉、氧化鋁等雜質)制備二氧化硅粗產品的工藝流程:
①洗滌石英砂的目的是___________________________________。
②二氧化硅與氫氧化鈉溶液反應的離子方程式是______________________
③在以上流程中,要將洗凈的石英砂研磨成粉末,目的是_____________。
④工業上常用純凈石英砂與C在高溫下發生反應制造粗硅,粗硅中含有SiC,其中Si和SiC的物質的量之比為1:1。下列說法正確的是________(填序號)。
A.SiC性質穩定,能用于制造抗高溫水泥
B.制造粗硅時的反應為:2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
C.在以上流程中,將鹽酸改為NaOH溶液,也可達到目的
D.純凈的SiO2只能用于制造光導纖維
 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:填空題
(13分)硫及其化合物有廣泛的應用,對SO2性質的研究是高中化學教學的一項重要內容。
(1)對比研究是一種重要的研究方法。若將硫的單質及部分化合物按如下表所示分成3組,則第2組中物質M的化學式是 。
| 第1組 | 第2組 | 第3組 |
| S(單質) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、、Na2SO4、NaHSO4 |
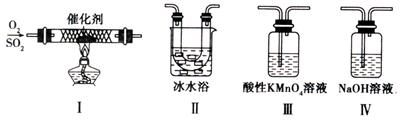
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在化學課上圍繞濃硫酸的化學性質進行了如下實驗探究,將適量的蔗糖放入燒杯中,加入幾滴水,攪拌均勻,然后加入濃硫酸,生成黑色物質。
請回答下列問題:
(1)生成的黑色物質(單質)是 (填化學式)。
(2)這種黑色物質繼續與濃硫酸作用會產生兩種氣體,其中一種氣體有刺激性氣味,是大氣的主要污染物之一,這種刺激性氣味的氣體成分是 (填化學式),反應的化學方程式為 。
(3)據蔗糖與濃硫酸反應的實驗現象,說明濃硫酸具有 (填序號)。
| A.酸性 | B.吸水性 | C.脫水性 | D.強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
濃硫酸在高中化學實驗中有著很重要的作用
(1)①銅與濃硫酸反應實驗時,發現試管底部有白色固體并夾雜有少量黑色固體。倒去試管中的濃硫酸,將剩余固體(含少量濃硫酸)倒入盛有少量水的燒杯中,發現所得溶液為藍色,黑色固體未溶解。過濾、洗滌后,向黑色固體中加入過量濃硝酸,黑色固體溶解,溶液呈藍色,所得溶液加BaCl2溶液后有白色沉淀生成。則黑色固體中含有________元素。
②實驗室利用濃硫酸分別與氯化鈉固體和碘化鉀固體加熱反應制取所需物質,分析這兩個反應中濃硫酸作用的異同點:_________________________________ 。
(2)探究濃硫酸的吸水性。某同學把98%的硫酸10mL和63.3%的硫酸(用10mL 98%的硫酸與10mL水配成)約20mL分別放入兩個相同的大表面皿中,根據室溫環境下實驗的數據繪成的曲線如圖。由右圖曲線你能得到的實驗結論有哪些?(寫兩點)______、_______________。
(3)苯與濃硝酸、濃硫酸制硝基苯的實驗中,三種原料混合的順序是_____________;要得到純凈的硝基苯,需經過:水洗 → 5%NaOH溶液洗滌 → 水洗 → 無水CaCl2干燥→________(填寫操作),得到純硝基苯。
(4)探究濃硫酸在生成乙酸乙酯反應中的作用。
問題提出:濃硫酸存在條件下酯化反應是否進行得更快。
設計實驗:____________________。實驗現象:___________________ 。
(5)濃硫酸與蔗糖反應的演示實驗裝置修改如下:實驗時在大試管中先放入2g細小顆粒的蔗糖,滴加2—3滴碳酸鈉濃溶液,再加入1.5mL 98%的濃硫酸,迅速塞緊帶干燥管的單孔橡皮塞。可以看到,蔗糖迅速變黑,體積急劇膨脹,形成多孔海綿狀固體物質——“黑面包”。分析實驗效果更加明顯的原因:____________________________________________________ 。
(6)苯分子等芳香烴化合物里的氫原子被硫酸分子里的磺酸基(—SO3H)所取代的反應,稱為磺化反應。濃硫酸有時也用SO3代替濃硫酸,其優點是____________________、__________________。(至少寫出兩點)
用濃硫酸吸收SO3可得發煙硫酸(H2SO4·SO3)。某化工廠用1.5m3 98.3%的濃硫酸(密度為1.84g/mL)吸收SO3形成發煙硫酸,再與水混合,可得到95%的硫酸(密度為1.79g/mL)________m3(保留2位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
下圖中A~J分別代表相關反應的一種物質。已知A分解得到等物質的量的B、C、D,圖中有部分生成物未標出。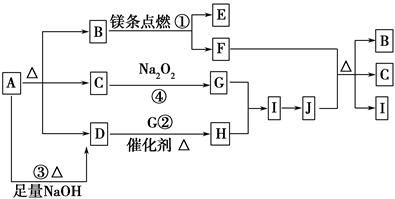
已知:2Mg+CO2 2MgO+C,請填寫以下空白:
2MgO+C,請填寫以下空白:
(1)A的化學式________。
(2)寫出反應②的化學方程式:________________________________________。
(3)寫出反應③的離子方程式:________________________________________。
(4)J與F反應的化學方程式:_________________________________________。
(5)在反應④中,當生成標準狀況下2.24 L G時,轉移電子數為________ mol。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
開發氫能是實現社會可持續發展的需要。硫鐵礦(FeS2)燃燒產生的SO2通過下列碘循環工藝過程既能制H2SO4,又能制H2。
請回答下列問題:
(1)已知1 g FeS2完全燃燒放出7.1 kJ熱量,FeS2燃燒反應的熱化學方程式為________________________________________________________。
(2)該循環工藝過程的總反應方程式為_____________________________________。
(3)用化學平衡移動的原理分析,在HI分解反應中使用膜反應器分離出H2的目的是_______________________________________________________。
(4)用吸收H2后的稀土儲氫合金作為電池負極材料(用MH表示),NiO(OH)作為電池正極材料,KOH溶液作為電解質溶液,可制得高容量,長壽命的鎳氫電池。電池充放電時的總反應為:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①電池放電時,負極的電極反應式為______________________________。
②充電完成時,Ni(OH)2全部轉化為NiO(OH)。若繼續充電將在一個電極產生O2,O2擴散到另一個電極發生電極反應被消耗,從而避免產生的氣體引起電池爆炸,此時,陰極的電極反應式為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)下列與含氯化合物有關的說法正確的是________(填字母)。
| A.HClO是弱酸,所以NaClO是弱電解質 |
| B.向沸水中逐滴加入少量飽和FeCl3溶液,可制得Fe(OH)3膠體 |
| C.HCl溶液和NaCl溶液均通過離子導電,所以HCl和NaCl均是離子化合物 |
| D.電解NaCl溶液得到22.4 L H2(標準狀況),理論上需要轉移NA個電子(NA表示阿伏加德羅常數) |
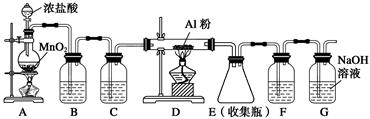
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Na2S2O3·5H2O 俗稱“海波”,是常用的脫氧劑、定影劑和還原劑;它是無色易溶于水的晶體,不溶于乙醇,在20 ℃ 和70 ℃ 時的溶解度分別為60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是實驗室制備及相關性質實驗。
制備海波的反應原理:Na2SO3+S Na2S2O3
Na2S2O3
制備海波的流程:
(1)實驗開始時用1 mL乙醇潤濕硫粉的作用是 。
A.有利于亞硫酸鈉與硫磺的充分接觸
B.防止亞硫酸鈉溶解
C.控制溶液的pH
D.提高產品的純度
(2)趁熱過濾的原因是 。
(3)濾液不采用直接蒸發結晶的可能原因是 。
(4)抽濾過程中需要洗滌產品晶體,下列液體最適合的是 。
A.無水乙醇 B.飽和NaCl溶液 C.水 D.濾液
(5)產品的純度測定:取所得產品10.0 g,配成500 mL溶液,再從中取出25 mL溶液于錐形瓶中,滴加幾滴淀粉作指示劑,然后用0.050 mol/L的標準碘水溶液滴定,重復三次,平均消耗20 mL標準碘水,涉及的滴定反應方程式為:I2+2Na2S2O3 2NaI+Na2S4O6。產品中的Na2S2O3·5H2O的純度為 %。
2NaI+Na2S4O6。產品中的Na2S2O3·5H2O的純度為 %。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
碳族元素是形成化合物種類最多的元素。
(1)碳原子2個2p電子的運動狀態不相同的方面是_______;C5HxN分子中C、N原于最外層都達到8電子穩定結構,則x的值可能為_______ (選填序號)。
a.10 b.11 c.13 d.15
(2)如圖是金剛石晶體的結構示意圖。則關于金剛石的描述正確的是 (選填序號)。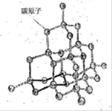
a.C-C鍵鍵角都為109°28’ b.最小的環由6個C原子構成
c.可溶于非極性溶劑 d.l mol金剛石含有4 mol C-C鍵
(3)以下比較錯誤的是________(選填序號)。
a.穩定性SiH4>CH4 b.沸點SiH4>CH4
c.熔點SiC>Si d.鍵能C=C>C-C
(4)NaBH4是廣泛使用的有機反應還原劑,其中H為-1價,SiO2為其制備原料之一。
①配平以下制備NaBH4的化學方程式:□Na2B4O7+□Na+□SiO2+□H2→□NaBH4+□Na2SiO3
②反應中被還原的元素為________。
(5)碳酸鈣是石灰石、方解石等的主要成分,可以形成“喀斯特”地貌、鐘乳和石筍,有關反應的化學方程式為_________________________________________。
(6)若物質組成相似,可相互推算組成元素的相對原子質量。某學習小組模擬求算鍺的相對原子質量,測得了鍺酸鈉中Na和Ge的質量分數、硅酸鈉中Na和Si的質量分數,他們還需查閱的數據是______(選填序號)。
a.氧元素的相對原子質量
b.硅元素的相對原子質量
c.鈉元素的相對原子質量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com