
| A. | TiCl4在反應I中是還原產物,在反應Ⅱ中是氧化劑 | |
| B. | C、Mg在反應中均為還原劑,被氧化 | |
| C. | 每生成19.2 g Ti,反應Ⅰ、Ⅱ中共轉移1.6 mol e- | |
| D. | 反應I中b=c=2,反應II中Mg的還原性大于Ti |
分析 反應Ⅰ中Ti元素化合價不變,Cl元素化合價降低,氯氣為氧化劑,C元素化合價升高,被氧化,C為還原劑,Ⅱ中Ti元素化合價降低,被還原,TiCl4為氧化劑,Mg為還原劑,結合質量守恒定律以及氧化還原反應得失電子數目相等的規律解答該題.
解答 解:A.aTiO2+bCl2+cC$\frac{\underline{\;1173K\;}}{\;}$aTiCl4+cCO該反應中反應前后,碳元素的化合價升高,碳單質作還原劑,氯元素的化合價降低,氯氣作氧化劑,還原產物是TiCl4;
TiCl4+2Mg$\frac{\underline{\;1220K~1420K\;}}{\;}$Ti+2MgCl2該反應中鈦元素的化合價降低,TiCl4作氧化劑;所以TiCl4在反應I中是還原產物,在反應II中是氧化劑,故A正確;
B.C、Mg在反應中反應前后化合價都升高,所以均為還原劑,被氧化,故B正確;
C.將方程式Ⅰ、Ⅱ相加得 TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 轉移電子
48g 8mol
19.2g 3.2mol
所以每生成19.2 g Ti,反應I、II中共轉移3.2 mol e-,故C錯誤;
D.根據反應前后各元素的原子個數守恒知,2a=c,2b=4a,則a=1、b=c=2,反應II中Mg能還原TiCl4,所以鎂的還原性大于Ti.
故選C.
點評 本題考查氧化還原反應的計算,側重于學生的分析能力和計算能力的考查,難度不大,注意基本概念的理解、氧化還原反應中得失電子相等等問題.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案科目:高中化學 來源: 題型:選擇題
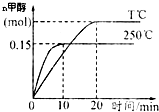 將1molCO和2molH2充入一容積為1L的密閉容器中,分別在250℃、T℃發生反應:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根據圖示判斷,下列結論正確的是( )
將1molCO和2molH2充入一容積為1L的密閉容器中,分別在250℃、T℃發生反應:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根據圖示判斷,下列結論正確的是( )| A. | a<0,T<250 | |
| B. | 250℃時,0~10min內:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡轉化率在250℃時比T℃大 | |
| D. | 250℃時,起始時向容器中改充1molCH3OH氣體,恒溫達平衡后,CH3OH的物質的量大于0.15mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鎂晶體需在氯化氫氣流的氛圍中加熱失水制得無水氯化鎂 | |
| B. | 夏天,打開碳酸飲料會有較多氣泡溢出 | |
| C. | 實驗室中常用排飽和食鹽水的方法收集氯氣 | |
| D. | 工業上生產氨氣時,采用高溫和催化劑等條件 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
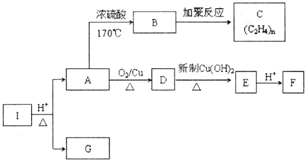 化合物I的分子式為C6H10O4,75%的A溶液常用于醫療消毒,與I相關的反應如圖.根據以上信息回答下列問題.
化合物I的分子式為C6H10O4,75%的A溶液常用于醫療消毒,與I相關的反應如圖.根據以上信息回答下列問題. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:3:2 | B. | 5:5:4 | C. | 2:2:3 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol
已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ/mol| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡氣體總濃度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 不慎將濃堿溶液沾到皮膚上,立即用大量硫酸沖洗,然后再用水沖洗 | |
| B. | 不慎將酸濺到眼中,立即用大量水沖洗,邊洗邊眨眼睛 | |
| C. | 實驗時手指上不小心沾上濃硫酸,立即用NaOH溶液清洗 | |
| D. | 酒精不慎灑在實驗桌上燒起來時,立即用水澆滅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
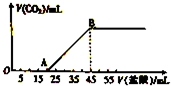 將5.08g由Na2CO3和NaHCO3組成的固體混合物完全溶于水,制成溶液,然后向該溶液中逐滴加入2mol?L-1的鹽酸,所加入鹽酸的體積與產生CO2體積(標準狀況)的關系如圖所示.
將5.08g由Na2CO3和NaHCO3組成的固體混合物完全溶于水,制成溶液,然后向該溶液中逐滴加入2mol?L-1的鹽酸,所加入鹽酸的體積與產生CO2體積(標準狀況)的關系如圖所示.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com