
分析 100mL 1mol/L的AlCl3溶液中氯化鋁的物質的量=0.2L×0.5mol/L=0.1mol,若Al元素都轉化為氫氧化鋁沉淀,則氫氧化鋁沉淀的質量=0.1mol×78g/mol=7.8g>3.9g,說明有兩種情況:一為氫氧化鈉體積較少,沉淀不完全,只生成Al(OH)3沉淀;另一種情況為氫氧化鈉體積較多,沉淀完全后又部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,結合方程式計算消耗氫氧化鈉物質的量,進而計算需要氫氧化鈉溶液體積.
解答 解:100mL 1mol/L的AlCl3溶液中n(AlCl3)=0.2L×0.5mol/L=0.1mol,若Al元素都轉化為氫氧化鋁沉淀,則氫氧化鋁沉淀的質量=0.1mol×78g/mol=7.8g>3.9g,說明有兩種情況:一為沉淀不完全,只生成Al(OH)3沉淀;另一種情況為沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若堿不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物質的量為0.05mol×3=0.15mol,加入NaOH溶液的體積為$\frac{0.15mol}{0.5mol/L}$=0.3L=300mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,則:
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3+OH-═AlO2-+2H2O
(0.1-0.05)mol (0.1-0.05)mol
則消耗的堿的物質的量為0.3mol+(0.1-0.05)mol=0.35mol,
加入NaOH溶液的體積為$\frac{0.35mol}{0.5mol/L}$=0.7L=700mL;
答:加入氫氧化鈉溶液的體積為300mL或700mL.
點評 本題考查化學方程式的有關計算,難度中等,關鍵是根據氯化鋁與氫氧化鋁的量判斷發生的反應,再結合反應的有關方程式計算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
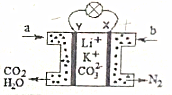 某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質、以CH3OH為燃料時,該電池工作原理如圖.下列說法正確的是( )
某種熔融碳酸鹽燃料電池以Li2CO3、K2CO3為電解質、以CH3OH為燃料時,該電池工作原理如圖.下列說法正確的是( )| A. | b為空氣,電子由X極經導線流向Y極 | |
| B. | 在熔融電解質中,CO32-向X極移動 | |
| C. | 消耗1molCH3OH,消耗氧氣分子數目約為3×6.02×1023 | |
| D. | 正極反應式為:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
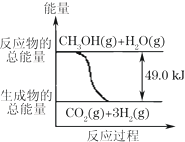 甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:
甲醇質子交換膜燃料電池中將甲醇蒸氣轉化為氫氣的兩種反應原理是:| A. | 1molCH3OH完全燃燒放熱192.9kJ | |
| B. | 反應①中的能量變化如右圖所示 | |
| C. | CH3OH轉變成H2的過程一定要吸收能量 | |
| D. | 根據②推知反應:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 陽離子 | K+ Na+ Cu2+ Al3+ |
| 陰離子 | SO42- HCO3-OH- Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com