
【題目】氯化亞銅(CuCl)常用作催化劑、殺菌劑等。
(1)將Na2SO3溶液逐滴加入到CuCl2溶液中,再加入少量濃鹽酸混勻,得到CuCl沉淀。該反應中被氧化的物質是______(填化學式)。
(2)為測定制得CuCl樣品的純度,進行下列實驗:a.稱取0.5000 g樣品,放入盛有 20 mL過量FeCl3溶液和玻璃珠的錐形瓶中,不斷搖動;b.待樣品溶解后,加水50 mL;c.立即用0.2000 mol·L-1 Ce(SO4)2標準溶液滴至反應完全,記錄消耗標準溶液的體積; d.重復步驟a至c 2次,記錄消耗標準溶液的平均體積為25.00 mL。
已知:CuCl + Fe3+ = Cu2+ + Fe2+ + Cl- Fe2+ + Ce4+ = Fe3+ + Ce3+
①配制100 mL 0.2000 mol·L-1 的Ce(SO4)2標準溶液時,需要的玻璃儀器除燒杯、量筒、玻璃棒、100 mL容量瓶外,還需要_______。
②通過計算確定該樣品中CuCl的純度。______
③進行步驟c時若操作緩慢,則測得CuCl的純度_______(“偏大”、“偏小”或“無影響”)。
【答案】Na2SO3 膠頭滴管 99.5% 偏小
【解析】
(1)鹽酸、亞硫酸根離子和銅離子發生氧化還原反應生成CuCl白色沉淀、硫酸根離子,氧化還原反應中,失電子化合價升高的反應物是被氧化的物質,也是還原劑,得電子化合價降低的反應物是被還原的物質,也是氧化劑;(2)①根據配制一定物質的量濃度的溶液使用的儀器解答;②依據方程式CuCl+Fe3+=Cu2++Fe2++Cl-、Fe2++Ce4+=Fe3++Ce3+中各反應物量之間的關系,可得關系式:CuCl~Ce4+,據此計算CuCl的純度;③步驟c發生反應:Fe2++Ce4+=Fe3++Ce3+,若操作緩慢,亞鐵離子被氧氣氧化。
(1)在Na2SO3的水溶液中逐滴加入CuCl2的水溶液中,再加入少量濃鹽酸混勻,傾出清液,抽濾即得CuCl沉淀,反應的離子方程式為:2Cu2++SO32-+2Cl+H2O=2CuCl↓+SO42-+2H﹢,該反應中化合價變化Cu(+2→+1),S(+4→+6),氧化還原反應中,失電子化合價升高的反應物是被氧化的物質,該反應中被氧化的物質是Na2SO3;
(2)①配制一定物質的量濃度溶液的一般步驟為:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻、裝瓶、貼標簽,配制100mL溶液用到的儀器有托盤天平(稱量)、藥匙、玻璃棒(溶解、移液)、膠頭滴管(定容)、燒杯(溶解)、100mL容量瓶(定容、搖勻)故還需要的玻璃儀器有:膠頭滴管;
②稱取0.5000g樣品,放入盛有 20mL過量FeCl3溶液和玻璃珠的錐形瓶中,不斷搖動;發生反應:CuCl+FeCl3═CuCl2+FeCl2,用0.2000molL-1 Ce(SO4)2標準溶液滴至反應完全,發生反應Fe2++Ce4+=Fe3++Ce3+,可得關系式:CuCl~Ce4+,故n(CuCl)=n(Ce4+)=0.2000molL-1×25.00×10-3L=5.000×10-3mol,則CuCl的純度為![]() ×100%=99.5%;
×100%=99.5%;
③亞鐵離子易被氧氣氧化,步驟c發生反應:Fe2++Ce4+=Fe3++Ce3+,根據CuCl~Ce4+,計算CuCl的純度,進行步驟c時若操作緩慢,被氧化的亞鐵離子不再與Ce4+反應,則測得CuCl的純度偏小。


科目:高中化學 來源: 題型:
【題目】由SiO2制備高純度硅的工業流程如圖所示:

下列說法錯誤的是
A. SiO2與純硅都是硬度大、熔沸點高的晶體
B. X為CO氣體
C. 反應②產生的H2與反應③產生的HCl可以循環使用
D. 反應①②③均為在高溫條件下的非氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組設計了下列裝置,驗證二氧化碳跟過氧化鈉反應時需要與水接觸。

(裝置分析)
(1)裝置①中反應的離子方程式是______。
(2)裝置②中的試劑是______(填序號)。
a.飽和NaHCO3溶液 b.飽和Na2CO3溶液 c.濃H2SO4
(3)裝置③中的試劑是______。
(進行實驗)
步驟1:打開彈簧夾K2,關閉K1,打開分液漏斗活塞加入鹽酸,將帶火星的木條
放在a處。
步驟2:打開彈簧夾K1,關閉K2,打開分液漏斗活塞加入鹽酸,將帶火星的木條
放在a處。
(1)步驟1和步驟2中,a處帶火星的木條產生的實驗現象分別是______。
(2)過氧化鈉跟二氧化碳反應的化學方程式是______。
(實驗反思)
(1)有同學提出質疑:“上述實驗不足以證明有水存在時過氧化鈉跟二氧化碳發生了化學反應。”其理由是______。
(2)需要補充的實驗操作是:取⑤中反應后的少量固體,______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫時,若Ca(OH)2和CaWO4(鎢酸鈣)的沉淀溶解平衡曲線如圖所示(已知![]() =0.58)。下列分析不正確的是
=0.58)。下列分析不正確的是
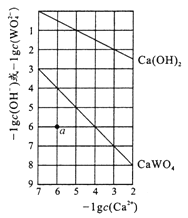
A. a點表示Ca(OH)2與CaWO4均未達到溶解平衡狀態
B. 飽和Ca(OH)2溶液和飽和CaWO4溶液等體積混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-)
C. 飽和Ca(OH)2溶液中加入少量Na2O,溶液變渾濁
D. 石灰乳與0.1mol/LNa2WO4溶液混合后發生反應:Ca(OH)2+WO42-=CaWO4+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研小組以難溶性鉀長石(K2O·Al2O3·6SiO2)為原料,提取Al2O3、K2CO3等物質,工藝流程如下:

(1)“煅燒”過程中有如下反應發生:
①鉀長石中的硅元素在CaCO3作用下轉化為CaSiO3,寫出SiO2轉化為CaSiO3的化學方程式: __________。
②鉀長石中的鉀元素和鋁元素在Na2CO3作用下轉化為可溶性的NaAlO2和KAlO2,寫出Al2O3轉化為NaAlO2的化學方程式:____________________________________。
(2)“轉化”時加入NaOH的主要作用是________________________(用離子方程式表示)。
(3)上述工藝中可以循環利用的主要物質是________________、_________________和水。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 與足量的10mol/L硫酸液混合微熱,產生下列現象:①有紅色金屬生成②產生刺激性氣味的氣體③溶液呈現藍色。據此判斷下列說法正確的是
與足量的10mol/L硫酸液混合微熱,產生下列現象:①有紅色金屬生成②產生刺激性氣味的氣體③溶液呈現藍色。據此判斷下列說法正確的是
A. 反應中硫酸作氧化劑
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性氣味的氣體是氨氣
D. 1mol![]() 完全反應轉移0.5mol電子
完全反應轉移0.5mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N2O5是一種新型硝化劑,一定溫度下發生反應2N2O5(g)4NO2(g)+O2(g) ΔH>0, T1溫度下的部分實驗數據如下表所示。
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/(mol/L) | 5.00 | 3.52 | 2.50 | 2.50 |
下列說法正確的是
A. 該反應在任何溫度下均能自發進行
B. T1溫度下的平衡常數為K1=125,1 000 s時N2O5(g)轉化率為50%
C. 其他條件不變時,T2溫度下反應到1 000 s時測得N2O5(g)濃度為2.98 mol/L,則T1<T2
D. T1溫度下的平衡常數為K1,T2溫度下的平衡常數為K2,若T1>T2,則K1<K2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向100 mL NaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入0.2 mol/L的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示。
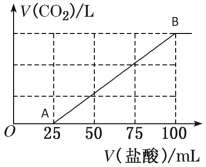
(1)A-B段的離子反應方程式為__________________________。
(2)原NaOH溶液的濃度為__________mol/L。
(3)通入CO2在標準狀況下的體積為_______mL。
(4)所得溶液的溶質成分是_______________,其物質的量之比為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鈉(Na2FeO4)是一種多功能、高效無毒的新型綠色水處理劑。
(1)Na2FeO4中鐵元素的化合價是______價,Na2FeO4能給水消毒利用的是________性。
(2)用Na2FeO4給水消毒、殺菌時得到的Fe3+可以凈水,Fe3+凈水原理是______________(用簡要的文字敘述)。
(3)工業上可用FeCl3、NaOH 、NaClO三種物質在一定條件下反應制得Na2FeO4,配平反應的離子方程式:_____Fe3+ +_____OH-+____ClO- =_____FeO42-+ _____![]() + ______Cl- ,____________氧化劑為________,若反應過程中轉移了0.5 mol電子,則還原產物的物質的量為________ mol。
+ ______Cl- ,____________氧化劑為________,若反應過程中轉移了0.5 mol電子,則還原產物的物質的量為________ mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com