
【題目】氯化亞砜(SOCl2)常用于醫藥、農藥、染料工業,也可在有機合成工業中作氯化劑。已知:SOCl2的相關性質如下表所示:
顏色、狀態 | 熔點 | 沸點 | 腐蝕性 | 水解 |
無色或微黃液體 | -105℃ | 78℃ | 強 | 極易水解 |
現利用如圖裝置制備SOCl2。
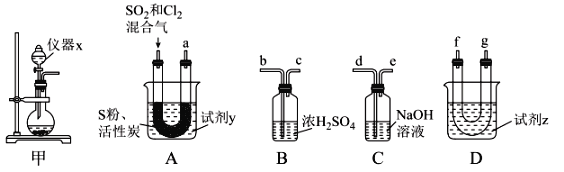
請回答下列問題:
Ⅰ.制備SO2和Cl2。
(1)本實驗選用裝置甲制備SO2和Cl2,裝置甲中儀器x的名稱為___;若以KMnO4和濃鹽酸反應制備Cl2,反應的離子方程式為___。
Ⅱ.制備SOCl2。
以活性炭作為催化劑,SO2和C12可以和S粉在180~200℃時反應合成SOCl2,選用裝置A、B、C、D進行制備(夾持、加熱裝置略去)。
(2)按氣流從左到右的方向,裝置A、B、C、D的連接順序為____(填儀器接口的字母編號)。
(3)試劑y為___(填選項字母,下同);試劑z為___。
A.熱水 B.乙醇 C.石蠟油 D.冰水
(4)裝置A中U形管內發生反應的化學方程式為___。
(5)裝置C的作用為___;若裝置A處通入的SO2和Cl2的物質的量之比為1:3,則裝置C中生成的鹽為___(填化學式)。
【答案】分液漏斗 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O afg(gf)bcde C D SO2+2Cl2+S![]() 2SOCl2 尾氣處理(或吸收未反應的SO2和Cl2) NaC1、NaClO和Na2SO4
2SOCl2 尾氣處理(或吸收未反應的SO2和Cl2) NaC1、NaClO和Na2SO4
【解析】
Ⅰ.(1)根據儀器構造可得;高錳酸鉀和濃鹽酸反應制備Cl2,同時生成氯化錳、氯化鉀和水;
Ⅱ.(2)A為制備裝置,D為收集裝置,B為干燥裝置,連接在D后防止水蒸氣進入,C為尾氣處理裝置;
(3)反應條件為在180~200℃,選擇石蠟油維持;裝置D為冷凝收集產品的裝置,試劑z為冷凝,據此分析;
(4)裝置A中U形管內為二氧化硫和氯氣在180~200℃催化劑催化下生成SOCl2;
(5)SO2和Cl2為有毒氣體,考慮尾氣處理;裝置A處通入的SO2和Cl2的物質的量之比為1:3,Cl2過量裝置C中發生的反應為SO2+Cl2+4NaOH═2NaCl+Na2SO4+2H2O、Cl2+2NaOH═NaCl+NaClO+H2O;
Ⅰ.(1)裝置甲中儀器x的名稱為分液漏斗;若選用裝置甲以高錳酸鉀和濃鹽酸反應制備Cl2,反應的離子方程式為2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案為:分液漏斗 ; 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O ;
Ⅱ.(2)按氣流從左到右的方向,A為制備裝置,D為收集裝置,B為干燥裝置,連接在D后防止水蒸氣進入,C為尾氣處理裝置,連接順序為afg(gf)bcde,
故答案為:afg(gf)bcde;
(3)試劑y為石蠟油,能保持油浴溫度為180~200℃;試劑z為冰水,冷凝收集生成的氯化亞砜,
故答案為C; D;
(4)裝置A中U形管內發生反應的化學方程式為SO2+2Cl2+S![]() 2SOCl2。
2SOCl2。
(5)裝置C的作用為吸收未反應的SO2和Cl2;若裝置A處通入的SO2和Cl2的物質的量之比為1:3,Cl2過量,則裝置C中發生的反應為SO2+Cl2+4NaOH=2NaCl+Na2SO4+2H2O、Cl2+2NaOH=NaCl+NaClO+H2O,生成的鹽為NaCl、Na2SO4和NaClO;
故答案為:尾氣處理(或吸收未反應的SO2和Cl2) ; NaC1、NaClO和Na2SO4


 互動英語系列答案
互動英語系列答案科目:高中化學 來源: 題型:
【題目】在標準狀況下,由甲烷、甲醛(HCHO)和乙烷組成的11.2升的混合氣體完全燃燒后,生成0.7mol的二氧化碳氣體。則混合氣體中乙烷的體積分數為( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中華文化源遠流長,如![]() 本草圖經
本草圖經![]() 中曾有對青礬的描述:“形似樸硝
中曾有對青礬的描述:“形似樸硝![]() 而綠色,取此物置于鐵板上,聚碳,封之囊袋,吹令火熾,其礬即沸,流出,色赤如融金升者是真也。”對于文中描述,下列說法正確的是
而綠色,取此物置于鐵板上,聚碳,封之囊袋,吹令火熾,其礬即沸,流出,色赤如融金升者是真也。”對于文中描述,下列說法正確的是![]()
![]()
A.樸硝既不屬于電解質也不屬于非電解質
B.青礬的成分為![]()
C.文中使用了蒸發結晶的分離方法
D.文中的反應涉及了氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒![]() 與氧同主族,硒元素及其化合物與人體健康、工業生產密切相關。某科研小組以陽極泥
與氧同主族,硒元素及其化合物與人體健康、工業生產密切相關。某科研小組以陽極泥![]() 主要成分是Se,含有CuSe,
主要成分是Se,含有CuSe,![]() 等雜質
等雜質![]() 為原料,提煉硒的流程如下:
為原料,提煉硒的流程如下:
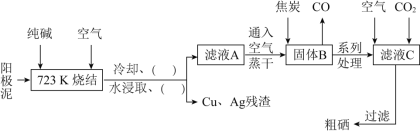
請回答下列問題:
![]() 硒原子的次外層電子數為________,與硒同周期相鄰元素是________
硒原子的次外層電子數為________,與硒同周期相鄰元素是________![]() 填元素名稱
填元素名稱![]() 。
。
![]() 已知濾液A中主要成分是
已知濾液A中主要成分是![]() ,可用于治療克山病,則
,可用于治療克山病,則![]() 的化學名稱為________;濾液C中主要成分是
的化學名稱為________;濾液C中主要成分是![]() ,則
,則![]() 的電子式為________。
的電子式為________。
![]() 上述流程圖中的括號內“
上述流程圖中的括號內“![]()
![]() ”,按操作先后順序依次填寫的內容是________、________。
”,按操作先后順序依次填寫的內容是________、________。
![]() 寫出高溫下用焦炭還原固體B的化學方程式________。
寫出高溫下用焦炭還原固體B的化學方程式________。
![]() 濾液C中析出硒的離子方程式為________。
濾液C中析出硒的離子方程式為________。
![]() 向
向![]() 溶液中滴加稍過量的乙酸,其離子方程式為________。已知:
溶液中滴加稍過量的乙酸,其離子方程式為________。已知:![]() 、
、![]() 、
、![]() 。
。
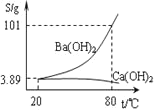
![]() 粗硒可采用真空蒸餾的方法進行提純,獲得純硒。真空蒸餾的揮發物中硒含量與溫度的關系如圖所示:
粗硒可采用真空蒸餾的方法進行提純,獲得純硒。真空蒸餾的揮發物中硒含量與溫度的關系如圖所示:
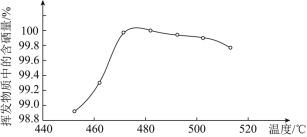
蒸餾操作中控制的最佳溫度是________![]() 填標號
填標號![]() 。
。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯的分子式為C2H4,是一種重要的化工原料和清潔能源,研究乙烯的制備和綜合利用具有重要意義。請回答下列問題:
(1)乙烯的制備:工業上常利用反應C2H6(g)=C2H4(g)+H2(g)△H制備乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3= -1559.9kJ·mol-1。
則△H=___kJ·mol-1。
(2)乙烯可用于制備乙醇:C2H4(g)+H2O(g)=C2H5OH(g)。向某恒容密閉容器中充入amolC2H4(g)和amol H2O(g),測得C2H4(g)的平衡轉化率與溫度的關系如圖所示:
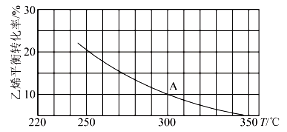
①該反應為___熱反應(填“吸”或“放”)。
②A點時容器中氣體的總物質的量為___。已知分壓=總壓×氣體物質的量分數,用氣體分壓替代濃度計算的平衡常數叫壓強平衡常數(KP),測得300℃時,反應達到平衡時該容器內的壓強為bMPa,則A點對應溫度下的KP=___MPa-1(用含b的分數表示)。
③已知:C2H4(g)+H2O(g)=C2H5OH(g)的反應速率表達式為v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆為速率常數,只與溫度有關。則在溫度從250℃升高到340℃的過程中,下列推斷合理的是___(填選項字母)。
A.k正增大,k逆減小 B.k正減小,k逆增大
C.k正增大的倍數大于k逆 D.k正增大的倍數小于k逆
④若保持其他條件不變,將容器改為恒壓密閉容器,則300℃時,C2H4(g)的平衡轉化率___10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化為乙醛(CH3CHO),電解乙醛的酸性水溶液可以制備出乙醇和乙酸,則生成乙酸的電極為____極(填“陰”或“陽”),對應的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸鋇是一種重要的無機鹽產品,廣泛應用于工業陶瓷、光學玻璃、建筑等行業。
![]() 生產制備:工業上一般以重晶石
生產制備:工業上一般以重晶石![]() 為原料,采用高溫煅燒還原法;實驗室一般以重晶石
為原料,采用高溫煅燒還原法;實驗室一般以重晶石![]() 為原料,采用沉淀轉化法。
為原料,采用沉淀轉化法。
高溫煅燒還原法:
![]()
![]() 煅燒還原的化學方程式為:_____________。
煅燒還原的化學方程式為:_____________。
![]() 為了提高浸取速率,可采取的措施是__________
為了提高浸取速率,可采取的措施是__________![]() 任寫一種
任寫一種![]() 。
。
![]() 經檢驗BaS的水溶液呈堿性,原因是
經檢驗BaS的水溶液呈堿性,原因是![]() 用離子方程式表示
用離子方程式表示![]() __________。
__________。
沉淀轉化法:向![]() 沉淀中加入飽和
沉淀中加入飽和![]() 溶液,充分攪拌,棄去上層清液。如此處理多次,直到
溶液,充分攪拌,棄去上層清液。如此處理多次,直到![]() 全部轉化為
全部轉化為![]() :
:![]() 平衡常數
平衡常數![]()
![]() 現有
現有![]() ,每次用
,每次用![]() 飽和
飽和![]() 溶液處理,假定
溶液處理,假定![]() 能全部轉化,至少需要處理_____________次。
能全部轉化,至少需要處理_____________次。
![]() 從“綠色化學”角度分析,用飽和
從“綠色化學”角度分析,用飽和![]() 溶液沉淀轉化法的優點是:__________。
溶液沉淀轉化法的優點是:__________。
![]() 分離提純
分離提純
某實驗室分離提純混有少量碳酸鈣雜質的碳酸鋇樣品的步驟如下:
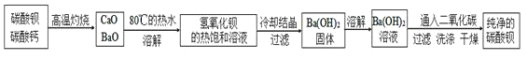
![]() 將灼燒后的固體混合物置于
將灼燒后的固體混合物置于![]() 的熱水中,制成氫氧化鋇的熱飽和溶液。為減少
的熱水中,制成氫氧化鋇的熱飽和溶液。為減少![]() 的損失并除去不溶物應進行的操作是_____。
的損失并除去不溶物應進行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一種試劑名稱
填一種試劑名稱![]() ,再通入二氧化碳。當觀察到_______時,即可停止通二氧化碳。
,再通入二氧化碳。當觀察到_______時,即可停止通二氧化碳。
![]() 環境監測
環境監測
![]() 環境監測某工廠廢水中
環境監測某工廠廢水中![]() 的濃度。取廢水
的濃度。取廢水![]() ,控制適當的酸度加入足量的
,控制適當的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時
沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時![]() 全部轉化為
全部轉化為![]() ,再加入過量KI溶液,反應液中再滴加
,再加入過量KI溶液,反應液中再滴加![]() 溶液,反應完全時,消耗
溶液,反應完全時,消耗![]() 溶液
溶液![]() 。已知有關的離子方程式為:
。已知有關的離子方程式為:![]() ;
;![]() 。
。
該工廠廢水中![]() 的物質的量濃度__________
的物質的量濃度__________![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,則下列敘述正確的是( )
①常溫常壓下,46g有機物C2H6O中含有極性鍵的數目一定為7NA;
②標準狀況下,22.4L四氯化碳中所含有的共價鍵數目為4NA;
③常溫下46gNO2和N2O4混合氣體中含有原子數為3NA;
④常溫常壓下,33.6L氯氣與56g鐵充分反應,轉移的電子數為3NA;
⑤足量鐵在氯氣中反應,lmol鐵失去的電子數為2NA;
⑥標準狀況下22.4LH2中含中子數為2NA;
⑦1LImol/L的鹽酸溶液中,所含氯化氫分子數為NA。
A.①④B.②⑤⑥C.③D.②④⑦
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組的同學用如圖所示裝置研究有關電化學的問題。當閉合該裝置的電鍵時,觀察到電流表的指針發生了偏轉。
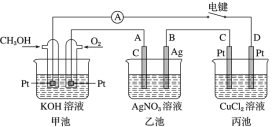
請回答下列問題:
(1)甲池為______(填“原電池”“電解池”或“電鍍池”),通入CH3OH 電極的電極反應式為 _____________________________________。
(2)乙池 A(石墨)電極的名稱為_________(填“正極”“負極”“陰極”或“陽極”),乙池中總反應式為 ____________________________________。
(3)當乙池中 B 極質量增加 5.40 g 時,甲池中理論上消耗 O2 的體積為_____________mL(標準狀況下),丙池中___________極析出 ______ g 銅。
(4)若丙中電極不變,將其溶液換成 NaCl 溶液,電鍵閉合一段時間后,丙中溶液的 pH 將_______(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸亞鐵![]() 為白藍色晶體,溶于強酸,不溶于水和乙醇。它是生產
為白藍色晶體,溶于強酸,不溶于水和乙醇。它是生產![]() 的原料,實驗室利用
的原料,實驗室利用![]() 、
、![]() 及
及![]() 為原料制備磷酸亞鐵的實驗流程如圖1:
為原料制備磷酸亞鐵的實驗流程如圖1:
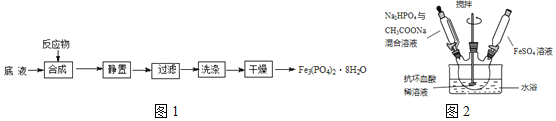
合成時的主要反應為:![]()
![]() 實驗中由原料配制溶液時,蒸餾水事先要煮沸、冷卻,煮沸的目的是______。
實驗中由原料配制溶液時,蒸餾水事先要煮沸、冷卻,煮沸的目的是______。
![]() 合成時,在三口燒瓶中先加入抗壞血酸
合成時,在三口燒瓶中先加入抗壞血酸![]() 稀溶液作底液,再向燒瓶中,滴入
稀溶液作底液,再向燒瓶中,滴入![]() 與
與![]() 混合溶液至
混合溶液至![]() 時,再滴入
時,再滴入![]() 溶液,最終維持
溶液,最終維持![]() 裝置如圖2所示
裝置如圖2所示![]() 。
。
![]() 實驗不是將三種溶液直接混合的原因是______。
實驗不是將三種溶液直接混合的原因是______。
![]() 用抗壞血酸溶液作底液而不用鐵粉,其主要原因是______。
用抗壞血酸溶液作底液而不用鐵粉,其主要原因是______。
![]() 生成的
生成的![]() 沉淀需充分洗滌,檢驗洗滌是否完全的方法是______
沉淀需充分洗滌,檢驗洗滌是否完全的方法是______
![]() 檢驗產品中是否混有
檢驗產品中是否混有![]() 或
或![]() 雜質的方法是______。
雜質的方法是______。
![]() 某研究性學習小組的同學擬用工業品十二水合磷酸氫二鈉
某研究性學習小組的同學擬用工業品十二水合磷酸氫二鈉![]() 含
含![]() 、重金屬鹽及有色雜質等
、重金屬鹽及有色雜質等![]() 提純得到
提純得到![]() 晶體。已知:
晶體。已知:![]() 溶液pH
溶液pH![]() ,重金屬硫化物不溶于水。
,重金屬硫化物不溶于水。
請補充實驗步驟
![]() 實驗中必須使用的試劑有:
實驗中必須使用的試劑有:![]() 溶液、活性炭、
溶液、活性炭、![]() 溶液、乙醇
溶液、乙醇![]() 磷酸氫二鈉在水中溶解度
磷酸氫二鈉在水中溶解度![]() 水
水![]()
溫度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|
|
|
|
| |||||||
|
| ||||||||||
|
|
|
|
|
| ||||||
|
|
將工業品溶于適量熱水,______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com