

| 時間/min | 0 | 10 | 20 | 30 | 40 |
| 總壓強/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
分析 (1)①根據(jù)壓強與氣體物質的量成正比確定反應后氣體的總物質的量;利用差量法計算出反應消耗乙苯的物質的量,然后計算出乙苯的轉化率;
②利用三段式計算出平衡時各組分的物質的量,然后利用平衡常數(shù)表達式計算出該溫度下該反應的平衡常數(shù);
(2)該反應為氣體體積增大的反應,減小壓強后平衡向著氣體體積增大的反應方向移動;再結合壓強對反應速率的影響分析.
解答 解:(1)①容器容積固定,則容器內壓強與氣體的總物質的量成正比,根據(jù)表中數(shù)據(jù)可知,達到平衡時壓強為反應前的1.4倍,則平衡時氣體的總物質的量為:amol×1.4=1.4amol;
平衡時氣體的物質的量增大:1.4amol-amol=0.4amol,設有x mol 乙苯發(fā)生轉化, △n
△n
1 1 1 1
xmol 0.4amol
則:x=$\frac{0.4amol×1}{1}$=0.4amol,
所以乙苯的轉化率為:$\frac{0.4amol}{amol}$×100%=40%,
故答案為:1.4a;40%;
②發(fā)生反應為
反應前(mol) a 0 0
轉化(mol) 0.4a 0.4a 0.4a
平衡時(mol) 0.6a 0.4a 0.4a
則該反應的平衡常數(shù)為:K=$\frac{\frac{0.4a}{V}×\frac{0.4a}{V}}{\frac{0.6a}{V}}$=$\frac{4a}{15V}$,
故答案為:$\frac{4a}{15V}$;
(2)根據(jù)反應方程式可知,該反應中氣體的分子數(shù)增加,則減小壓強后平衡右移,乙苯轉化率增大,苯乙烯產(chǎn)率增加;減小壓強后使乙苯濃度減小,則反應速率減小,
故答案為:該反應分子數(shù)增加,減小壓強使平衡右移,乙苯轉化率增大,苯乙烯產(chǎn)率增加,減小壓強使乙苯濃度減小,反應速率減小.
點評 本題考查了化學平衡的計算,題目難度中等,明確化學平衡及其影響為解答關鍵,注意掌握三段式在化學平衡的計算中的應用方法,試題培養(yǎng)了學生的分析能力及化學計算能力.


 本土教輔贏在暑假高效假期總復習云南科技出版社系列答案
本土教輔贏在暑假高效假期總復習云南科技出版社系列答案 暑假作業(yè)北京藝術與科學電子出版社系列答案
暑假作業(yè)北京藝術與科學電子出版社系列答案 第三學期贏在暑假系列答案
第三學期贏在暑假系列答案科目:高中化學 來源: 題型:解答題

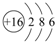 .
. .
.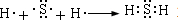 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C的體積分數(shù)增大 | B. | 平衡向右移動 | C. | B的轉化率提高 | D. | a+b<c+d |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 燃煤產(chǎn)生的煙氣中的氮氧化物NOx(主要為NO、NO2)易形成污染,必須經(jīng)脫除達標后才能排放.
燃煤產(chǎn)生的煙氣中的氮氧化物NOx(主要為NO、NO2)易形成污染,必須經(jīng)脫除達標后才能排放.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
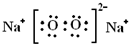 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1molNa2O2中含有的離子數(shù)為0.4NA | |
| B. | 利用氧化還原反應原理制取1mol氧氣,轉移的電子數(shù)一定為4NA | |
| C. | 7.1g氯氣與足量NaOH溶液反應電子轉移數(shù)為0.2NA | |
| D. | 0.1mol氯氣與金屬鐵完全反應時,轉移電子數(shù)為0.2NA |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com