
(10分)請回答下列問題:
(1)等溫、等容下,已知2NO+O2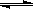 2NO2 △H<0,當該反應處于平衡狀態時,下列措施中有利于提高NO的平衡轉化率的是
(填字母)。
2NO2 △H<0,當該反應處于平衡狀態時,下列措施中有利于提高NO的平衡轉化率的是
(填字母)。
A.升高溫度 B.降低溫度 C.加入O2 D.減小壓強
E.加入催化劑 F.增加NO的量
(2)若將l.00 molO2和2.00 mol NO混合充入容積為2 L的密閉容器中,3分鐘后反應達到平衡。平衡后混合氣體總物質的量為2.55mol,用O2表示的化學反應速率為 mol•L-1•min-1。
(3)容積均為2 L的四個密閉容器中均進行著(2)中的反應,某溫度下,各物質物質的量(mol)及正逆反應速率關系如下表所示:
|
容器編號 |
n(O2) |
n(NO) |
n (NO2) |
v正與v逆的關系 |
|
Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
|
Ⅱ |
0.20 |
0.40 |
1.00 |
②v正___v逆? |
|
Ⅲ |
0.60 |
1.20 |
0.80 |
③v正___v逆? |
①若方程式系數為最簡整數比,則該溫度下的平衡常數K=
填寫表中空格: ② ③ (填>或 <)
(10分)(1) B、C、 (2)0.075(3) ①40 ②< ③ >
【解析】(1)考查外界條件對平衡的影響。正反應是體積減小的、放熱的可逆反應,所以降低溫度或增大壓強或增大氧氣的濃度,平衡都向正反應方向進行,NO的轉化率都是增大的。催化劑不能改變平衡狀態,轉化率不變。增加NO濃度,平衡向正反應方向進行,但NO的轉化率降低,所以答案選BC。
(2)設消耗氧氣的物質的量是x,則消耗NO是2x,生成NO2是2x,則1-x+2-2x+2x=2.55,解得x=0.45,所以用O2表示的化學反應速率為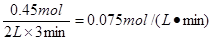 。
。
(3)正逆反應速率相等時即達到平衡狀態,所以根據容器I可知,該溫度下的平衡常數K=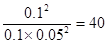 ;容器Ⅱ中此時
;容器Ⅱ中此時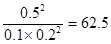 ,所以反應向逆反應方向進行,則正反應速率小于逆反應速率;同樣可知容器Ⅲ中此時
,所以反應向逆反應方向進行,則正反應速率小于逆反應速率;同樣可知容器Ⅲ中此時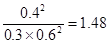 ,所以反應向正反應方向進行,則正反應速率大于逆反應速率。
,所以反應向正反應方向進行,則正反應速率大于逆反應速率。


科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
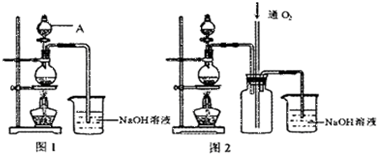
 硫酸銅是一種應用極其廣泛的化工原料.銅不能與稀硫酸直接反應,本實驗中將適量濃硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶得到硫酸銅晶體(裝置如圖所示).
硫酸銅是一種應用極其廣泛的化工原料.銅不能與稀硫酸直接反應,本實驗中將適量濃硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶得到硫酸銅晶體(裝置如圖所示).| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Fe(OH)2 | 開始沉淀pH | 2.7 | 4.8 | 7.6 | 完全沉淀pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化學 來源:2010-2011學年浙江省杭州市高三第二次質檢(理綜)化學部分 題型:實驗題
(15分)實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶得到硫酸銅晶體。
(1)為了節約原料,硫酸和硝酸的物質的量之比最佳為: : ;
為了吸收該反應中產生的尾氣,請選擇下列中合適的裝置 。

(2)為符合綠色化學的要求,某研究性學習小組進行如下設計:
第一組:以空氣為氧化劑法
方案1:以空氣為氧化劑。將銅粉在儀器B中反復灼燒,使銅與空氣充分反應生成氧化銅,再將氧化銅與稀硫酸反應。
方案2:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發現在常溫下幾乎不反應。向反應液中加少量FeSO4,即發生反應,生成硫酸銅。反應完全后,加物質甲調節pH ,鐵元素全部沉淀(一般認為鐵離子的濃度下降到10-5 mol·L-1,就認為沉淀完全),然后過濾、濃縮、結晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
請回答下列問題:
如開始加入的銅粉為3.2 g,最后所得溶液為500 mL,溶液中含有鐵元素0.005 mol。①方案1中的B儀器名稱是 。
②為了使鐵元素全部沉淀,應調節pH至少為_________。
③方案2中甲物質可選用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反應中加入少量FeSO4可加速銅的氧化,用離子方程式解釋其原因 。
第二組:過氧化氫為氧化劑法
將3.2g銅絲放到45 mL 1.5mol·L-1的稀硫酸中,控溫在50℃。加入18mL 10%的H2O2,反應0.5h,升溫到60℃,持續反應1 h后,過濾、蒸發濃縮、減壓抽濾等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
請回答下列問題:
⑤反應時溫度控制在50℃~60℃不宜過高的原因是 ,
⑥本實驗CuSO4·5H2O的產率為 。
查看答案和解析>>
科目:高中化學 來源:2010-2011學年山東省兗州市高三第三次模擬考試(理綜)化學部分 題型:填空題
實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶得到硫酸銅晶體。
(1)為了節約原料,硫酸和硝酸的物質的量之比最佳為: ;為了吸收該反應中產生的尾氣,請選擇下列中合適的裝置 。

(2)為符合綠色化學的要求,某研究性學習小組進行如下設計:
第一組:以空氣為氧化劑法
方案1:以空氣為氧化劑。將銅粉在儀器B中反復灼燒,使銅與空氣充分反應生成氧化銅,再將氧化銅與稀硫酸反應。
方案2:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發現在常溫下幾乎不反應。向反應液中加少量FeSO4,即發生反應,生成硫酸銅。反應完全后,加物質甲調節pH ,鐵元素全部沉淀(一般認為鐵離子的濃度下降到10-5 mol·L-1,就認為沉淀完全),然后過濾、濃縮、結晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
請回答下列問題:
如開始加入的銅粉為3.2 g,最后所得溶液為500 mL,溶液中含有鐵元素0.005 mol。
①方案1中的B儀器名稱是 。
②為了使鐵元素全部沉淀,應調節pH至少為_________。
③方案2中甲物質可選用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反應中加入少量FeSO4可加速銅的氧化,用離子方程式解釋其原因 。
第二組:過氧化氫為氧化劑法
將3.2g銅絲放到45 mL 1.5mol·L-1的稀硫酸中,控溫在50℃。加入18mL 10%的H2O2,反應0.5h,升溫到60℃,持續反應1 h后,過濾、蒸發濃縮、減壓抽濾等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
請回答下列問題:
⑤反應時溫度控制在50℃~60℃不宜過高的原因是 ,
⑥本實驗CuSO4·5H2O的產率為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com