
【題目】將一定質量的鎂、銅合金加入到稀硝酸中,合金完全溶解,假設反應過程中還原產物全部是NO,向所得溶液中加入物質的量濃度為3mol/L的NaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1g,則下列有關敘述正確的是( )
A.反應中轉移電子的總數為0.3mol
B.反應過程中,消耗硝酸的物質的量為0.3mol
C.沉淀完全時消耗NaOH溶液的體積為100mL
D.開始加入合金的質量可能為3.4g
【答案】A
【解析】解:將鎂和銅組成的混合物加入到稀HNO3中,金屬完全溶解(假設反應中還原產物只有NO),發生反應:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反應后的溶液中加入過量的3mol/L NaOH溶液至沉淀完全,發生反應:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3 , 沉淀為氫氧化鎂和氫氧化銅,生成沉淀的質量比原合金的質量增加5.1g,則氫氧化鎂和氫氧化銅含有氫氧根的質量為5.1g,氫氧根的物質的量為:n(OH﹣)= ![]() =0.3mol,根據反應方程式可知,鎂和銅的總的物質的量為:n=
=0.3mol,根據反應方程式可知,鎂和銅的總的物質的量為:n= ![]() ×n(OH﹣)=0.15mol,
×n(OH﹣)=0.15mol,
A.根據分析可知,反應中注意電子的物質的量=氫氧根離子的物質的量﹣0.3mol,故A正確;
B.根據方程式可知參加反應的n反應(HNO3)= ![]() (金屬)=
(金屬)= ![]() ×0.15mol=0.4mol,故B錯誤;
×0.15mol=0.4mol,故B錯誤;
C.反應消耗氫氧化鈉的物質的量為:n(NaOH)=n(OH﹣)=0.3mol,則加入的氫氧化鈉溶液的體積至少為: ![]() =0.1L=100mL,若硝酸過量,則消耗的氫氧化鈉溶液體積大于100mL,故C錯誤;
=0.1L=100mL,若硝酸過量,則消耗的氫氧化鈉溶液體積大于100mL,故C錯誤;
D.根據反應方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,鎂和銅的總的物質的量為銅離子物質的量的一半,即: ![]() =0.15mol,假定全為鎂,金屬質量為0.15mol×24g/mol=3.6g,若全為銅,金屬質量為:0.15mol×64g/mol=9.6g,所以參加反應的金屬的總質量(m)范圍為:3.6g<m<9.6g,則金屬質量不可能為3.4g,故D錯誤;
=0.15mol,假定全為鎂,金屬質量為0.15mol×24g/mol=3.6g,若全為銅,金屬質量為:0.15mol×64g/mol=9.6g,所以參加反應的金屬的總質量(m)范圍為:3.6g<m<9.6g,則金屬質量不可能為3.4g,故D錯誤;
故選A.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】實行垃圾分類,關系廣大人民群眾生活環境,關系節約使用資源,也是社會文明水平的一個重要體現。有害垃圾指對人體健康或者自然環境造成直接或者潛在危害的生活廢棄物。下列不屬于有害垃圾的是
A.過期藥物B.廢舊電池C.廢殺蟲劑D.金屬易拉罐
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是 ( )
A. 除去乙醇中微量水用金屬鈉 B. 溴苯中混有溴,加入水萃取
C. 用酸性高錳酸鉀除去乙烷中的乙烯 D. 可用分液漏斗分離硝基苯和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請根據下圖作答:
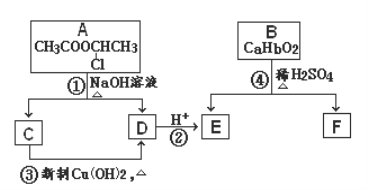
已知:一個碳原子上連有兩個羥基時,易發生下列轉化:![]()
(1)反應①所屬的有機反應類型是_______________反應。
(2)反應③的化學方程式__________________________________________________。
(3)已知B的相對分子質量為162,其完全燃燒的產物中n(CO2)∶n (H2O) = 2∶1,則B的分子式為___________。
(4)F是高分子光阻劑生產中的主要原料。F具有如下特點:①能跟FeCl3溶液發生顯色反應;②能發生加聚反應;③苯環上的一氯代物只有兩種。F在一定條件下發生加聚反應的化學方程式為___________。
(5)化合物G是F的同分異構體,屬于芳香族化合物,能發生銀鏡反應。G的結構有_____________種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組將純凈的SO2氣體通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀.為探究上述溶液中何種微粒能氧化通入的SO2 , 該小組提出了如下假設:
假設一:溶液中的NO3﹣
假設二:溶液中溶解的O2;
(1)驗證假設一
該小組設計實驗驗證了假設一,請在下表空白處填寫相關實驗現象.
實驗步驟 | 實驗現象 | 結論 |
實驗1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的燒杯中,緩慢通入純凈的SO2氣體 | 假設一成立 | |
實驗2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的燒杯中,緩慢通入純凈的SO2氣體 |
(2)為深入研究該反應,該小組還測得上述兩個實驗中溶液pH隨通入SO2體積的變化曲線如圖: 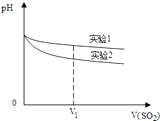
實驗1中溶液pH變小的原因是;V1時,實驗2中溶液pH小于實驗1的原因是(用離子方程式表示).
(3)該小組還設計了實驗驗證假設二,請在實驗4橫線處寫出實驗步驟.
實驗步驟 | 實驗現象 | 結論 |
實驗3:在盛有不含O2的25m10.1mol/LBaCl2溶液的燒杯中,緩慢通入純凈的SO2氣體 | ||
實驗4: |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高分子分離膜可以讓某些物質有選擇地通過而將物質分離,下列應用不屬于高分子分離膜的應用范圍的是( )
A. 分離工業廢水,回收廢液中的有用成分
B. 食品工業中,濃縮天然果汁,乳制品加工和釀酒
C. 將化學能轉換成電能,將熱能轉換成電能
D. 海水淡化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖所示的過程中的能量變化情況,判斷下列說法正確的是

A. H2(g)轉化為氫原子是一個放熱過程
B. 1molH2和1molCl2的總能量比2molHCl的總能量低
C. 1 個 HCl(g)分子中的化學鍵斷裂時需要吸收431.8 kJ能量
D. 2HCl(g)= H2(g)+Cl2(g)的反應熱ΔH=+184.5 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙、丙三種化合物均由氫、氮、氧、銅四種元素中的兩種組成.常溫下,甲是一種含氮質量分數為87.5%的液態化合物,其相對分子質量與空氣中某種主要成分的相對分子質量相等;乙和丙是銅的兩種常見氧化物,乙是新制氫氧化銅與乙醛反應的還原產物.試回答下列問題:
(1)甲的結構式 .
(2)甲是一種二元弱堿,則甲與過量硫酸反應的產物為(寫化學式).16g甲在空氣中充分燃燒,生成一種常見液態物質和氮氣,放出311kJ熱量,則其熱化學方程式為 .
(3)甲和丙反應的產物中含有乙和一種氣態單質,寫出其化學方程式 .
(4)向乙的固體中加入過量硫酸酸化的硫酸鐵溶液,乙固體完全溶解,得到透明溶液.
①寫出其離子方程式 .
②若所得溶液中陽離子濃度均約為0.1mol/L,再向所得混合溶液中加丙,最先得到沉淀(不同濃度的陽離子開始和完全以氫氧化物沉淀的pH如圖).
③向上述混合液中加入有機萃取劑(RH)發生反應:2RH(有機相)+Cu2+(水相)R2Cu(有機相)+2H+(水相),已知其它陽離子與該有機物不能發生反應,也不相溶.請設計實驗方案,驗證有機相中含有銅元素 . 
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com