

| 離子 | 離子半徑(pm) | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
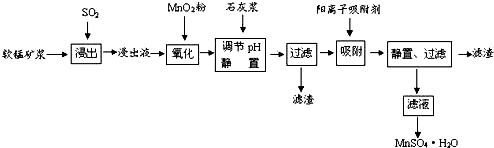
分析 高溫焙燒含硫廢渣產生的SO2廢氣,軟錳礦漿的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金屬離子主要是Mn2+,則MnO2與SO2發生氧化還原反應,浸出液還含有少量的Fe2+、Al3+等其他金屬離子,Fe2+具有還原性,可以被MnO2在酸性條件下氧化成Fe3+,在氧化后的液體中加入石灰漿,雜質中含有Fe2+、Al3+、Ca2+、Pb2+四種陽離子,由沉淀的pH范圍知,Fe2+的沉淀與Mn2+離子的沉淀所需的pH接近,而Fe3+則相差很遠,故可以將Fe2+氧化成Fe3+而除雜.從吸附率的圖可以看出,Ca2+、Pb2+的吸附率較高,故只要調節pH值在4.7~8.3間,Fe3+、Al3+陽離子通過調pH值,轉化為氫氧化鐵、氫氧化鋁沉淀,同時生成微溶的硫酸鈣,過濾,濾渣主要有氫氧化鐵、氫氧化鋁、硫酸鈣,由于制取的MnSO4•H2O含有結晶水,故操作a采用蒸發濃縮結晶的方法,得到MnSO4•H2O,
(1)從流程圖看,浸出過程是軟錳礦漿(MnO2)與SO2的反應;
(2)雜質離子中只有Fe2+具有還原性,可以被MnO2在酸性條件下氧化成Fe3+;
(3)從表可以看出,只要調節pH值在4.7~8.3間,大于4.7可以將Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀;
(4)結合半徑,分析右圖知,圖中離子從上至下,半徑有減小趨勢,對應的吸附率減小.隨著時間的遞增,所有離子的吸附率均增大;另Fe3+和Al3+離子所帶電荷數大,其吸附率低,從吸附率的圖可以看出,Ca2+、Pb2+的吸附率較高,
(5)2.00×10-2 mol•L-1Na2SO4溶液中c(SO42-)=2.00×10-2 mol•L-1,根據Ksp(CaSO4)=c(Ca2+)•c(SO42-),可求得c(Ca2+),進而確定c的值.
解答 解:高溫焙燒含硫廢渣產生的SO2廢氣,軟錳礦漿的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金屬離子主要是Mn2+,則MnO2與SO2發生氧化還原反應,浸出液還含有少量的Fe2+、Al3+等其他金屬離子,Fe2+具有還原性,可以被MnO2在酸性條件下氧化成Fe3+,在氧化后的液體中加入石灰漿,雜質中含有Fe2+、Al3+、Ca2+、Pb2+四種陽離子,由沉淀的pH范圍知,Fe2+的沉淀與Mn2+離子的沉淀所需的pH接近,而Fe3+則相差很遠,故可以將Fe2+氧化成Fe3+而除雜.從吸附率的圖可以看出,Ca2+、Pb2+的吸附率較高,故只要調節pH值在4.7~8.3間,Fe3+、Al3+陽離子通過調pH值,轉化為氫氧化鐵、氫氧化鋁沉淀,同時生成微溶的硫酸鈣,過濾,濾渣主要有氫氧化鐵、氫氧化鋁、硫酸鈣,由于制取的MnSO4•H2O含有結晶水,故操作a采用蒸發濃縮結晶的方法,得到MnSO4•H2O,
(1)低品位軟錳礦漿的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金屬離子主要是Mn2+,則MnO2與SO2發生氧化還原反應,反應的化學方程式為SO2+MnO2=MnSO4,故答案為:SO2+MnO2=MnSO4;
(2)雜質離子中只有Fe2+具有還原性,可以被MnO2在酸性條件下氧化成Fe3+,反應的離子方程式為2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案為:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)調節pH值用到的儀器是pH計,雜質中含有Fe3+、Al3+陽離子,從圖可表以看出,大于4.7可以將Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要調節pH值在4.7~8.3間即可.
故答案為:pH計;4.7≤pH<8.3;
(4)圖中離子從上至下,半徑有減小趨勢,對應的吸附率減小.隨著時間的遞增,所有離子的吸附率均增大;另Fe3+和Al3+離子所帶電荷數大,其吸附率低,雜質中含有Fe2+、Al3+、Ca2+、Pb2+四種陽離子,由沉淀的pH范圍知,Fe2+的沉淀與Mn2+離子的沉淀所需的pH接近,而Fe3+則相差很遠,故可以將Fe2+氧化成Fe3+而除雜.從吸附率的圖可以看出,Ca2+、Pb2+的吸附率較高,
故答案為:吸附時間、金屬離子半徑、金屬離子電荷;Pb2+、Ca2+;
(5)c mol•L-1CaCl2溶液與2.00×10-2 mol•L-1Na2SO4溶液等體積混合,混合后Na2SO4的濃度為1.00×10-2 mol•L-1,根據Ksp(CaSO4)=c(Ca2+)•c(SO42-),可知混合溶液中c(Ca2+)=$\frac{Ksp(CaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{9.10×1{0}^{-6}}{1.00×1{0}^{-2}}$ mol•L-1=9.10×10-4 mol•L-1,所以混合前c=2×9.10×10-4 mol•L-1=1.82×10 -3mol•L-1,
故答案為:1.82×10 -3mol•L-1.
點評 本題以制備硫酸錳的生產流程為知識載體,考查化學反應的書寫,及除雜中的問題,題目難度中等,本題注意把握數據處理能力和圖象分析能力.


 奪冠訓練單元期末沖刺100分系列答案
奪冠訓練單元期末沖刺100分系列答案 新思維小冠軍100分作業本系列答案
新思維小冠軍100分作業本系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 利用廢鋁箔(主要成分為Al、少量的Fe、Si等)既可制取有機合成催化劑AlBr3又可制取凈水劑硫酸鋁晶體[A12(SO4)3•18H2O].
利用廢鋁箔(主要成分為Al、少量的Fe、Si等)既可制取有機合成催化劑AlBr3又可制取凈水劑硫酸鋁晶體[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 時間(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 熔點/℃ | 沸點/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X、Y、Z形成的化合物中不可能既有離子鍵 | |
| B. | X和Z、M和Y、Z和W均可形成原子個數比為1:1的化合物 | |
| C. | Y、Z、W、M形成的簡單離子半徑大小關系為Y>Z>M>W | |
| D. | W與Cl形成化合物的熔點低于M與Cl形成化合物的熔點 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水電離的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能使石蕊呈藍色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | $\frac{{K}_{W}}{c(O{H}^{-})}$=l×l0-13mol/L的溶液中:Ba2+、ClO-、Cl-、NO3- | |
| D. | 能與鋁反應放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、Mg2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com