
【題目】環己酮是工業上主要用作有機合成的原料溶劑,可由最簡單芳香烴A經如圖流程制得:
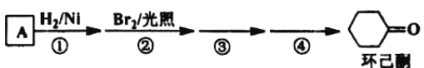
回答下列問題:
(1)反應①的反應類型為___反應,③的反應類型為___。
(2)反應④所用的試劑為___。
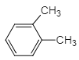
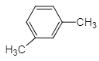
(3)A的同系物(C8H10)所有可能的結構簡式為___。
(4)環己酮的還原產物能與乙酸產生乙酸乙酯,請寫出產生酯的條件:___。
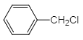
(5)寫出A的相鄰同系物合成![]() 的合成路線___。
的合成路線___。
合成路線的常用表示方式為:A![]() B……
B……![]() 目標產物。
目標產物。
【答案】加成 取代 Cu/O2加熱 ![]() 、
、 、
、 、
、![]() 濃硫酸,加熱
濃硫酸,加熱 ![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。
【解析】
最簡單的芳香烴為![]() ,與氫氣加成生成
,與氫氣加成生成![]() ,與Br2在光照條件下發生取代反應,根據環己酮的結構簡式可知取代產物為
,與Br2在光照條件下發生取代反應,根據環己酮的結構簡式可知取代產物為![]() ,在氫氧化鈉醇溶液加熱條件發生取代反應生成
,在氫氧化鈉醇溶液加熱條件發生取代反應生成![]() ,之后羥基被催化氧化生成環己酮。
,之后羥基被催化氧化生成環己酮。
(1)反應①為苯環的加成反應;反應③為鹵代烴的取代反應;
(2)反應④為羥基的催化氧化,需要Cu/O2加熱;
(3)A為![]() ,其同系物分子式為C8H10,則可能是苯環上有一個乙基,或兩個甲基,所有可能的結構簡式為
,其同系物分子式為C8H10,則可能是苯環上有一個乙基,或兩個甲基,所有可能的結構簡式為![]() 、
、 、
、 、
、![]() ;
;
(4)根據題意可知環己酮可以還原生成乙醇,乙醇在濃硫酸加熱的條件下可以與乙酸反應生成酯;
(5)A的相鄰同系物為![]() ,可以在光照條件與鹵族單質發生取代反應,之后鹵原子發生取代反應生成苯甲醇,之后再進行苯環的加成生成
,可以在光照條件與鹵族單質發生取代反應,之后鹵原子發生取代反應生成苯甲醇,之后再進行苯環的加成生成![]() ,所以合成路線為:
,所以合成路線為:![]()
![]()
![]()
![]()
![]()
![]() 。
。


科目:高中化學 來源: 題型:
【題目】25℃時,取濃度均為0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分別用0.1 mol·L-1NaOH溶液、0.1 mol·L-1鹽酸進行中和滴定,滴定過程中pH隨滴加溶液的體積變化關系如右圖所示。下列說法正確的是
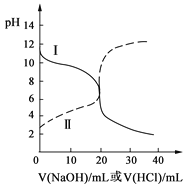
A.曲線Ⅰ:滴加溶液到10 mL時:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲線Ⅰ:滴加溶液到20 mL時:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.曲線Ⅱ:滴加溶液在10 mL~20 mL之間存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲線Ⅱ:滴加溶液到10 mL時:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮的氧化物(NOx)是大氣污染物之一,工業上在一定溫度和催化劑條件下用NH3將NOx還原生成N2,某同學在實驗室中對NH3與NOx反應進行了探究。回答下列問題:
(1)氨氣的制備

①氨氣的發生裝置可以選擇上圖中的________,反應的化學方程式為______________。
②預收集一瓶干燥的氨氣,選擇上圖中的裝置,其連接順序為:發生裝置→______(按氣流方向,用小寫字母表示)。
(2)氨氣與二氧化氮的反應將上述收集到的NH3充入注射器X中,硬質玻璃管Y中加入少量催化劑,充入NO2(兩端用夾子K1、K2夾好)。在一定溫度下按圖示裝置進行實驗。

操作步驟 | 實驗現象 | 解釋原因 |
打開K1,推動注射器活塞,使X中的氣體緩慢通入Y管中 | ①Y管中_____________ | ②反應的化學方程式 ____________ |
將注射器活塞退回原處并固定,待裝置恢復到室溫 | Y管中有少量水珠 | 生成的氣態水凝集 |
打開K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ. 已知,CO 的毒性表現在 CO 與血紅蛋白(Hb)結合成Hb·CO,使血紅蛋白失去輸送 O2功能。CO進入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人體體溫 37℃下,該平衡常數為 220。試回答:
O2+Hb·CO,已知在人體體溫 37℃下,該平衡常數為 220。試回答:
(1)煤氣中毒病人,可以通過進入高壓氧艙的方法來救治,請用化學平衡的原理加以說明:______。
(2)抽煙時,進入肺部的空氣中c(CO)=10-6mol·L-1,c(O2)=10-2mol·L-1,則c(Hb·CO)為c(Hb·O2)的___________倍。
(3)已知當血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02時,人的智力會很快受到損傷,為避免人的智力受到損傷,c(O2)與c(CO)的比值應大于_____。
Ⅱ.在某一溫度條件下, Bodensteins 研究了反應:2HI(g)![]() H2(g) +I2(g),氣體混合物中 HI 的物質的量濃度x(HI)(mol·L-1)與反應時間t的關系如下表:
H2(g) +I2(g),氣體混合物中 HI 的物質的量濃度x(HI)(mol·L-1)與反應時間t的關系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次試驗 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次試驗 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(4)根據上述實驗結果,該反應的平衡常數K的計算式為_________。
(5)上述反應,正反應速率為v正=k正x2(HI),逆反應速率為v逆=k逆x(H2)×x(I2),其中k正、k逆為速率常數,則k逆為_________(以K和k正表示)。若k正=0.002·min-1,第一次實驗時,當t=20 min,v正=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關敘述正確的是( )

A. 如圖所示,測定中和熱時,大小兩燒杯間填滿碎紙條或泡沫塑料的目的是固定小燒杯
B. 若用50 mL 0.55 mol·L-1的氫氧化鈉溶液,分別與50 mL 0.50 mol·L-1的鹽酸和50 mL 0.50 mol·L-1的硫酸充分反應,兩反應測定的中和熱不相等
C. 為了簡化裝置,中和熱測定實驗中的環形玻璃攪拌棒可以由溫度計代替
D. 中和熱測定實驗也可以用稀硫酸與氫氧化鈉溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,可逆反應X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始濃度分別為C1、C2、C3(均不為0),平衡時,X、Y、Z的濃度分別為0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,則下列判斷不合理的是
2Z(g),若X、Y、Z起始濃度分別為C1、C2、C3(均不為0),平衡時,X、Y、Z的濃度分別為0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,則下列判斷不合理的是
A. C1∶C2=1∶3 B. 平衡時,Y和Z的生成速率之比為3∶2
C. X、Y的轉化率不相等 D. C1的取值范圍為0<C1<0.14 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用銅片、銀片、Cu(NO3)2溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)設計成一個原電池如口圖所示,下列判斷中正確的是( ).

A.該原電池的工作原理是Cu+2Ag+=2Ag+Cu2+
B.實驗過程中取出鹽橋,原電池能繼續工作
C.實驗過程中,左側燒杯中NO3-濃度不變
D.實驗過程中電子流向為:Cu極→Cu(NO3) 2溶液→AgNO3溶液→Ag極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I. 有機物A可由葡萄糖發酵得到,也可從酸牛奶中提取。純凈的A為無色液體,易溶于水。為研究A 的組成與結構,進行了如下實驗:
實驗步驟 | 解釋或實驗結論 |
①稱取9.0gA,升溫使其氣化,測其密度是相同條件下H2的45 倍 | 試通過計算填空:(1)A的相對分子質量為________ |
②將此9.0gA在足量純O2中充分 燃燒,并使其產物依次緩緩通過濃硫酸、堿石灰,發現兩者分別增重5.4g和13.2g | (2)A的分子式為________ |
③又知A含有官能團—COOH、—OH,且A的核磁共振氫譜如圖: |
|
(3)綜上所述,A的結構簡式為________ | |
II. 工業上常以A物質為原料合成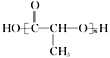 ,該反應類型屬于______(填字母代號,下同)反應。
,該反應類型屬于______(填字母代號,下同)反應。
A 加聚 B 縮聚
III. 下列關于物質的分離、提純實驗中的一些操作或做法,正確的是_______。
A 在組裝蒸騮裝置時,溫度計的水銀球應伸入液面下
B 用96%的工業酒精制取無水乙醇時,先加入無水CuSO4,再過濾
C 在苯甲酸重結晶實驗中,粗苯甲酸加熱溶解后還要加入少量蒸餾水
D 在苯甲酸重結晶實驗中,待粗苯甲酸完全溶解后要冷卻到常溫再過濾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃,幾種物質的pH和濃度如下表所示。回答下列問題:
序號 | ① | ② | ③ | ④ |
溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸 | 鹽酸 |
pH | 11 | 11 | 3 | 3 |
濃度 | c1 | c2 | c3 | c4 |
(1)c1____(填“>”“<”或“=”)c2。
(2)溶液中水的電離程度②____(填“>”“<”或“=”)③。
(3)分別加水稀釋10倍,稀釋后四種溶液的pH由大到小的順序為____(填序號)。
(4)①溶液與④溶液等體積混合,溶液的pH____7(填“>”“<“或“=”),用④溶液滴定①溶液,滴定過程中不可能出現的結果是____。
A. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(5)氫氧化銅懸濁液中有如下平衡:Cu(OH)2(s)![]() Cu2+(aq)+2OH-(aq),常溫下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸銅溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,應調整溶液使之pH>_____。
Cu2+(aq)+2OH-(aq),常溫下,Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸銅溶液里c(Cu2+)=0.02 mol/L,如要生成Cu(OH)2沉淀,應調整溶液使之pH>_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com