
【題目】金晶體的最小重復單元(也稱晶胞)是面心立方體,即在立方體的8個頂點各有一個金原子,各個面的中心有一個金原子,每個金原子被相鄰的晶胞所共有(如圖)。金原子的直徑為d,用NA表示阿伏加德羅常數,M表示金的摩爾質量。

(1)金晶體每個晶胞中含有________個金原子。
(2)欲計算一個晶胞的體積,除假定金原子是剛性小球外,還應假定_______。
(3)一個晶胞的體積是多少?
(4)金晶體的密度是多少?
 同步輕松練習系列答案
同步輕松練習系列答案科目:高中化學 來源: 題型:
【題目】一個體重50Kg的健康人大約含鐵2g,這2g鐵在人體中不是以單質金屬形式存在,而是以Fe2+和Fe3+的形式存在。二價鐵離子易被吸收,給貧血者補充鐵時,應給予含二價鐵離子的二價鐵鹽,如硫酸亞鐵(FeSO4)。服用維生素C,可使食物中的三價鐵離子還原成二價鐵離子,有利于鐵的吸收。
(1) “服用維生素C,可使食物中三價鐵離子還原成二價鐵離子。”這句話指出,維生素C在這一反應中做_________劑,具有________性。
(2) 向沸水中滴加飽和的FeCl3溶液制備Fe(OH)3膠體,則其離子方程式為:______________________。
(3) 為了驗證Fe3+的性質,某化學興趣小組設計了如下圖所示的一組實驗,實驗方案設計錯誤的是_____(填字母)

A. ④和⑤ B. 只有③ C. ③和④ D. ①②③
(4) 已知:氧化性Cl2>Br2>Fe3+,還原性Fe2+>Br->Cl-,則向1L 0.2mol·L-1的FeBr2溶液中通入標準狀況下氯氣2.24L,被氧化的粒子是________,此反應的離子方程式:____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN)是一種新型無機材料,廣泛應用于電子、陶瓷等工業領域.在一定條件下,AlN可通過反應Al2O3+N2+3C![]() 2AlN+3CO合成.已知AlN可與NaOH溶液反應放出有刺激性氣味的氣體.下列敘述正確的是
2AlN+3CO合成.已知AlN可與NaOH溶液反應放出有刺激性氣味的氣體.下列敘述正確的是
A. 上述反應中,N2是還原劑,Al2O3是氧化劑
B. 上述反應中,每生成1molAlN需轉移6mol電子
C. AlN中氮元素的化合價為+3
D. AlN與NaOH溶液反應的化學方程式為:AlN+NaOH+H2O═NaAlO2+NH3↑
查看答案和解析>>
科目:高中化學 來源: 題型:
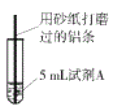
【題目】研究小組進行右圖所示實驗,試劑A為0.2mol/LCuSO4溶液,發現鋁條表面無明顯變化,于是改變實驗條件,探究鋁和CuSO4溶液、CuCl2溶液反應的影響因素。用不同的試劑A進行實驗1~實驗4,并記錄實驗現象:
實驗序號 | 試劑A | 實驗現象 |
1 | 0.2mol/LCuCl2溶液 | 鋁條表面有氣泡產生,并有紅色固體析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定質量的NaCl固體 | 開始鋁條表面無明顯變化,加NaCl后,鋁條表面有氣泡產生,并有紅色固體析出 |
3 | 2mol/LCuSO4溶液 | 鋁條表面有少量氣泡產生,并有少量紅色固體 |
4 | 2mol/LCuCl2溶液 | 反應非常劇烈,有大量氣泡產生,溶液變成棕褐色,有紅色固體和白色固體生成 |
(1)實驗1中,鋁條表面析出紅色固體的反應的離子方程式為_________。
(2)實驗2的目的是證明銅鹽中的陰離子Cl-是導致實驗1中反應迅速發生的原因,實驗2中加入NaCl固體的質量為______g。
(3)實驗3的目的是_________ 。
(4)經檢驗可知,實驗4中白色固體為CuCl。甲同學認為產生白色固體的原因可能是發生了Cu+CuCl2=2CuCl的反應,他設計了右圖所示實驗證明該反應能夠發生。
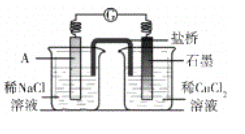
①A極的電極材料是_________。
②能證明該反應發生的實驗現象是_________ 。
(5)為探究實驗4中溶液呈現棕褐色的原因,分別取白色CuCl固體進行以下實驗:
實驗序號 | 實驗操作 | 實驗現象 |
i | 加入濃NaCl溶液 | 沉淀溶解,形成無色溶液 |
ii | 加入飽和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由無色變為褐色 |
查閱資料知:CuCl難溶于水,能溶解在Cl-濃度較大的溶液中,生成[CuCl2]
①由述球實驗及資料可推斷,實驗4中溶液呈棕褐色的原因可能是[CuCl2]-與_____作用的結果。
②為確證實驗4所得的棕褐色溶液中含有[CuCl2]-,應補充的實驗是_______。
(6)上述實驗說明,鋁和CuSO4溶液、CuCl2溶液的反應現象與______有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉硫電池以熔融金屬鈉、熔融硫和多硫化鈉(Na2Sx)分別作為兩個電極的反應物,固體Al2O3陶瓷(可傳導Na+)為電解質,其反應原理如圖所示。下列說法不正確的是
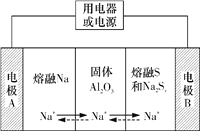
A. 放電時,電極A為負極,Na+由A極向B極移動
B. 該電池不能在常溫下工作
C. 充電時,電極B連接外電源的負極
D. 放電時,B極的電極反應式為xS+2e-===S![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com