
下列金屬中,表面自然形成的氧化層能保護內層金屬不被空氣氧化的是
| A.K | B.Na | C.Fe | D.Al |
 奪冠金卷全能練考系列答案
奪冠金卷全能練考系列答案科目:高中化學 來源: 題型:計算題
工業上由鋁土礦(主要成分是Al2O3和Fe2O3)和焦炭制備無水AlCl3的流程如下
已知:AlCl3,FeCl3,分別在183℃、315℃升華
(1)在焙燒爐中發生反應:
①Fe2O3(s)+3C(s)  2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反應2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化爐中高溫下發生反應,當生成1molAlCl3。時轉移______mol電子;爐氣中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其離子方程式為:____________________________。在溫度約為700℃向升華器中加入鋁粉,發生反應的化學方程式為_______________。充分反應后溫度降至____________以下(填“183℃、315℃之一),開始分離收集AlCl3。
②將AlCl3· 6H2O溶于濃硫酸進行蒸餾,也能得到一定量的無水AlCl3,此原理是利用濃硫酸下列性質中的____(填字母序號)。
①氧化性 ②吸水性 ③難揮發性 ④脫水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋燈塔電池是利用鋁、石墨為電極材料,海水為電解質溶液,構成電池的其正極反應式 ________;與鉛蓄電池相比.釋放相同電量時,所消耗金屬電極材料的質量比m(Al):m(Pb)=_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
Na2SO3在空氣中易被氧化而變質。某同學為證明Na2SO3有還原性,從一瓶實驗室長期存放的Na2SO3固體中取出少量溶于水,滴入一定量的燒堿溶液和少許溴水,振蕩后溶液變為無色。
(1)在堿性溶液中Br2和Na2SO3反應的離子方程式 。
(2)反應后的溶液含有SO32-、SO42-、Br-、OH-等陰離子,下表是某同學鑒定其中SO32-、SO42-和Br-的實驗報告,請完成未填完的部分。
限選試劑:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制飽和氯水;品紅溶液。
| 編號 | 實驗操作 | 預期現象和結論 |
| 步驟① | 取少量待測液加入試管中,加入過量2mol·L-1HCl,再滴加適量1 mol·L-1BaCl2 溶液。 | 有白色沉淀生成,證明待測液中含有、SO42- 。 |
| 步驟② | | |
| 步驟③ | | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
觀察是研究物質性質的一種基本方法.一同學將一小塊金屬鈉露置于空氣中,觀察到下列現象:銀白色→①變灰暗→②變白色→③出現液滴→④白色固體,下列說法中正確的是 ( )
| A.①發生了氧化還原反應 | B.②變白色是因為生成了碳酸鈉 |
| C.③是碳酸鈉吸收空氣中的水蒸氣形成了溶液 | D.④只發生物理變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
如圖所示,甲、乙、丙、丁分別代表Na2CO3、NaOH、NaHCO3、CO2四種物質,a、b、c、d、e、f分別表示兩種物質間的轉化關系。對于圖中兩種物質間的轉化,通過一步反應就能實現的有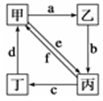
| A.只有a、b、c、d | B.只有b、c、d、e |
| C.只有c、d、e、f | D.a、b、c、d、e、f |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
把一塊鎂鋁合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物質的量隨加入NaOH溶液的體積變化的關系如下圖所示,下列說法中錯誤的是( )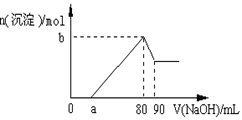
| A.鹽酸的體積為80ml | B.a的取值范圍為0≤ a <50 |
| C.n(Mg2+)<0.025mol | D.當a值為30時,b值為0.01 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
要使金屬晶體熔化必須破壞其中的金屬鍵。金屬晶體熔、沸點高低和硬度大小一般取決于金屬鍵的強弱。由此判斷下列說法正確的是
| A.金屬鎂的熔點高于金屬鋁 |
| B.堿金屬單質的熔、沸點從Li到Cs是逐漸升高的 |
| C.金屬鎂的硬度小于金屬鈣 |
| D.金屬鋁的硬度大于金屬鈉 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com