
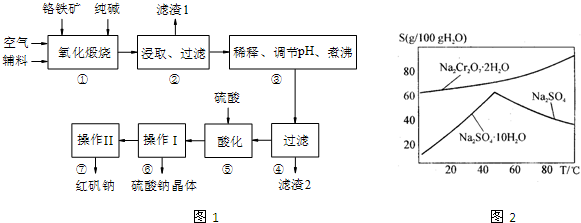
重鉻酸鈉(Na2Cr2O7?2H2O)俗稱紅礬鈉,在工業方面有廣泛用途.我國目前主要是以鉻鐵礦(主要成份為FeO?Cr2O3,還含有Al2O3、MgO、SiO2等雜質)為主要原料進行生產,c其主要工藝流程如下:

①中涉及的主要反應有:
主反應:4FeO?Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反應: SiO2+Na2CO3 Na2SiO3+CO2↑
Al2O3+Na2CO3
Na2SiO3+CO2↑
Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分陽離子以氫氧化物形式完全沉淀時溶液的pH:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
|
完全沉淀時溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
試回答下列問題:
(1) “①”中反應是在回轉窯中進行,反應時需不斷攪拌,其作用是 ;
(2) “③”中調節pH至4.7,目的是 ;
(3) “⑤”中加硫酸酸化的目的是使CrO42-轉化為Cr2O72-,請寫出該平衡轉化的離子方程式: ;
(4)稱取重鉻酸鈉試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol?L-1H2SO4和足量碘化鈉(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol?L-1Na2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是:
②若實驗中共用去Na2S2O3標準溶液40.00ml,所得產品的中重鉻酸鈉的純度
(設整個過程中其它雜質不參與反應)
(1)使反應物接觸更充分,加快反應速率;使反應物接觸更充分,加快反應速率
(2)除去溶液中的AlO2-、SiO32-
(3)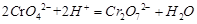 2CrO42-+2H+
2CrO42-+2H+ Cr2O72-+H2O
Cr2O72-+H2O
(4)①當滴加最后一滴硫代硫酸鈉溶液時,溶液藍色褪去,半分鐘內不變色
②83.84%
【解析】
試題分析:(1)回轉窯中發生反應的物質為鉻鐵礦和純堿,反應過程中不斷攪拌,可以使得固體間的接觸面增大,從而加快反應速率。
(2)由提供的信息“部分陽離子以氫氧化物形式完全沉淀時溶液的pH”,可得出Al(OH)3完全沉淀的pH為4.7,故調節pH至4.7,可將鋁元素轉化為沉淀。
(3)“加硫酸酸化”可看出,反應物中應該含有H+,故其離子方程式為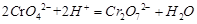
(4)①滴定終點的標志是:當滴加最后一滴硫代硫酸鈉溶液時,溶液藍色褪去,半分鐘內不變色 。
②此過程中發生的離子反應為: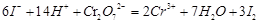
I2+2S2O32-=2I-+S4O62- ,可得關系式:
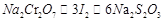
262 6
X 0.04×0.12mol
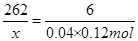 ,x=0.2096g;
,x=0.2096g;
故產品的純度為: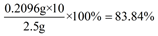
考點:離子反應;純度計算;滴定實驗;
點評:本題以工業生產流程的形式,綜合考查了離子反應、滴定實驗等知識,屬于難度較大的綜合題。解題時,應先明確實驗目的、實驗原理、實驗過程;其中,對流程圖的分析就是對整個實驗過程的分析。解題的關鍵在于分析流程圖中每一個步驟發生的反應。


科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
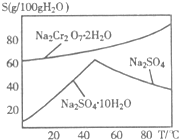 重鉻酸鈉(Na2Cr2O7)主要用于印染、制革、醫藥、電鍍等.工業上以鉻鐵礦(主要成分FeO?Cr2O3)、碳酸鈉、氧氣和硫酸為原料生產重鉻酸鈉(Na2Cr2O7?2H2O)的主要反應如下:
重鉻酸鈉(Na2Cr2O7)主要用于印染、制革、醫藥、電鍍等.工業上以鉻鐵礦(主要成分FeO?Cr2O3)、碳酸鈉、氧氣和硫酸為原料生產重鉻酸鈉(Na2Cr2O7?2H2O)的主要反應如下:
| ||
. |
| 溫度 | 0℃ | 100℃ |
| 溶解度 | ||
| 物質 | ||
| K2Cr2O7 | 4.6g | 94.1g |
| KCl | 28g | 55g |
| NaCl | 35g | 39g |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
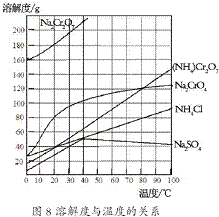 (2012?江蘇一模)重鉻酸銨[(NH4)2Cr2O7]是一種桔黃色結晶,可用作有機合成催化劑、實驗室制純凈的N2及Cr2O3等.實驗室可由工業級鉻酸鈉(Na2CrO4)為原料制取.有關物質溶解度如圖所示.實驗步驟如下:
(2012?江蘇一模)重鉻酸銨[(NH4)2Cr2O7]是一種桔黃色結晶,可用作有機合成催化劑、實驗室制純凈的N2及Cr2O3等.實驗室可由工業級鉻酸鈉(Na2CrO4)為原料制取.有關物質溶解度如圖所示.實驗步驟如下:2- 3 |
2- 6 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 高溫 |
| 高溫 |
| 高溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| A、反應①和②均為氧化還原反應 |
| B、反應①的氧化劑是O2,還原劑是FeO?Cr2O3 |
| C、高溫下,O2的氧化性大于Fe3O3小于NaCrO4. |
| D、生成1mol的Na2Cr2O7時整個反應過程共轉移6mol電子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com