
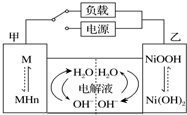
 發展混合動力車是實施節能減排的重要措施之一.汽車上坡或加速時,電動機提供推動力,降低了汽油的消耗;在剎車和下坡時電動機處于充電狀態以節省能耗.混合動力車的電動機目前一般使用的是鎳氫電池,鎳氫電池采用鎳的化合物為正極,儲氫金屬(以M表示)為負極,電解液為堿液(主要為KOH)(見圖).鎳氫電池充放電原理總反應式為:H2+2NiOOH$?_{充電}^{放電}$2Ni(OH)2.下列有關混合動力車的判斷正確的是( )
發展混合動力車是實施節能減排的重要措施之一.汽車上坡或加速時,電動機提供推動力,降低了汽油的消耗;在剎車和下坡時電動機處于充電狀態以節省能耗.混合動力車的電動機目前一般使用的是鎳氫電池,鎳氫電池采用鎳的化合物為正極,儲氫金屬(以M表示)為負極,電解液為堿液(主要為KOH)(見圖).鎳氫電池充放電原理總反應式為:H2+2NiOOH$?_{充電}^{放電}$2Ni(OH)2.下列有關混合動力車的判斷正確的是( )| A. | 在剎車和下坡時,甲電極的電極反應式為:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速時,甲電極周圍溶液的pH將減小 | |
| C. | 在上坡或加速時,溶液中的K+向甲電極遷移 | |
| D. | 在剎車和下坡時,乙電極增重 |
分析 A、電解池的陰極上水得電子發生還原反應;
B、在上坡或加速時,放電過程為原電池,根據甲中的電極反應來分析pH;
C、放電過程為原電池,原電池工作時,溶液中的陽離子向正極遷移;
D、在剎車和下坡時,乙電極為陽極,是氫氧化鎳轉化為NiOOH的過程.
解答 解:A、在剎車和下坡時電池處于充電狀態即電解池的工作原理,甲電極是陰極,氫離子發生得電子發生還原反應,電極反應式為2H2O+2e-=H2↑+2OH-,故A錯誤;
B、混合動力車上坡或加速時,屬于原電池的工作原理,電動機提供推動力,是電池放電,由圖轉化關系可知,NiOOH轉變為Ni(OH)2,電極反應式為NiOOH+H2O+e-=Ni(OH)2+OH-,而甲電極周圍氫氣失去電子變氫離子,所以氫離子濃度變大,溶液的pH將減小,故B正確;
C、放電過程為原電池,原電池工作時,溶液中的陽離子鉀離子向,正極即乙電極遷移,故C錯誤;
D、在剎車和下坡時,屬于電解池的工作原理,乙電極為陽極,是氫氧化鎳轉化為NiOOH的過程,電極質量減輕,故D錯誤;
故選B.
點評 本題考查學生原電池和電解池的工作原理知識,注意平時知識的積累以及基礎知識的掌握,難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | KAl(SO4)2溶液:c(SO42-)>(K+)=c(Al3+ )>c(H+)>c(OH-) | |
| B. | NaHCO3溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| C. | Na2S溶液:c(OH-)-(H+)=c(HS-)+c(H2S) | |
| D. | CH3COONa與 HCl混合后呈中性的溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.0×10-3 mol•L-1鹽酸的pH=3.0,1.0×10-7.5 mol•L-1鹽酸的pH=7.5 | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好無色,則此時溶液的pH<7 | |
| C. | 在醋酸溶液的pH=a,將此溶液稀釋10倍后,溶液的pH=b,則a>b | |
| D. | 若1mLpH=1的鹽酸與100mLNaOH溶液混合后,溶液的pH=7,則NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| Y | |||
| M | X | Z |
| A. | 鈉與Z可能形成只含離子鍵的Na2Z、Na2Z2化合物 | |
| B. | X的最高價氧化物不與任何酸反應 | |
| C. | Y的最簡單氣態氫化物的熱穩定性比X的強,因為Y的最簡單氣態氫化物分子間存在氫鍵 | |
| D. | M的簡單離子半徑是同周期中簡單離子半徑最小的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗目的或結論 |
| A | 在硅酸鈉溶液中滴入稀鹽酸,溶液變渾濁. | 非金屬性:Cl>Si |
| B | C2H5Br與Br2的溶液混合中加入Na2SO3溶液充分振蕩后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化鋇溶液產生白色沉淀,再加稀硝酸沉淀不消失 | 說明原溶液中一定含有 SO42- |
| D | 向無水乙醇中加入濃H2SO4,加熱至170°C產生的氣體通入酸性KMnO4溶液,紅色褪去 | 證明生成的氣體全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | pH=4的氯化銨溶液中,c(H+)=c(NH3•H2O)=1×10-4mol•L-1 | |
| B. | 由CH3COOH與CH3COONa組成的pH=5.6的混合溶液中:c(Na+)<c(CH3COO-) | |
| C. | pH=2的HF溶液與pH=12的NaOH溶液體積比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) | |
| D. | pH相同的①NaOH ②NaClO兩種溶液中水的電離程度:①<② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
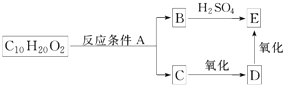
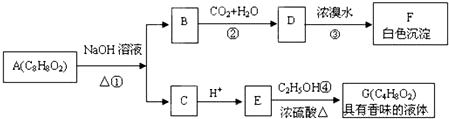
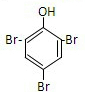 .
.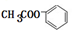 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$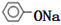 +CH3COONa+H2O.
+CH3COONa+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙酸是重要的有機化工原料,可由乙烯氧化法、甲醛羥基化法等方法生產.回答下列問題:
乙酸是重要的有機化工原料,可由乙烯氧化法、甲醛羥基化法等方法生產.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com