
【題目】常溫下,將0.01molNH4Cl和0.002molNaOH溶于水,形成1L混合溶液:
(1)該溶液中存在三個平衡體系,用電離方程式或離子方程式表示:
①____________
②____________
③____________。
(2)溶液中含有的微粒是__________________。
(3)在上述溶液中,電荷守恒是:____________。
【答案】
(1)H2O![]() H++OH-,NH3·H2O
H++OH-,NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(2)H2O,NH3·H2O,NH4+,OH-,H+,Cl-,Na+
(3)c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(Cl-)
【解析】
試題分析:(1)NH4Cl中有弱離子NH4+,所以在水溶液中會發生水解反應生成NH3·H2O,同時存在H2O和NH3·H2O的電離,故答案為:H2O![]() H++OH-,NH3·H2O
H++OH-,NH3·H2O![]() NH4++OH-,NH4++H2O
NH4++OH-,NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(2)根據(1)的方程式可知,溶液中存在的微粒有H2O,NH3·H2O,NH4+,OH-,H+,Cl-,Na+,故答案為:H2O,NH3·H2O,NH4+,OH-,H+,Cl-,Na+;
(3)根據溶液中存在的陰陽離子,電荷守恒即使陽離子所帶總電荷的濃度與陰離子所帶電荷的濃度相等,關系式為c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(Cl-),故答案為:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(Cl-)。


科目:高中化學 來源: 題型:
【題目】有機物A可以通過不同的反應得到B和C:
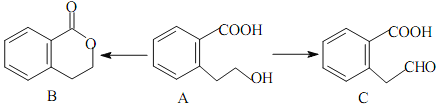
(1)A的分子式為_________________,C的含氧官能團名稱為_________________。
(2)A制取C的有機反應類型為_________________;A制取B的化學方程式為:_________________。
(3)A發生消去反應后產物的結構簡式為_________________,A分子中一定共面的碳原子有_________________個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修3: 物質結構與性質】鈦、鉻、鐵、鎳、銅等金屬及其化合物在工業上有重要用途。
(1)鈦鐵合金是鈦系儲氫合金的代表,該合金具有放氫溫度低、價格適中等優點。
①Ti的基態原子價電子排布式為________________。
②Fe的基態原子共有________種不同能級的電子。
(2)制備CrO2Cl2的反應為K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化學方程式中非金屬元素電負性由大到小的順序是______________(用元素符號表示)。
②COCl2分子中所有原子均滿足8電子構型,COCl2分子中σ鍵和π鍵的個數比為________,中心原子的雜化方式為________。
(3)NiO、FeO的晶體結構均與氯化鈉的晶體結構相同,其中Ni2+和Fe2+的離子半徑分別為6.9×10-2 nm和7.8×10-2 nm。則熔點:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用廣泛的儲氫材料,具有大容量、高壽命、耐低溫等特點,在日本和中國已實現了產業化。
該合金的晶胞結構如圖所示。

①該晶體的化學式為________________。
②已知該晶胞的摩爾質量為M g·mol-1,密度為d g·cm-3。設NA為阿伏加德羅常數的值,則該晶胞的體積是________ cm3(用含M、d、NA的代數式表示)。
③該晶體的內部具有空隙,且每個晶胞的空隙中儲存6個氫原子比較穩定。已知:a=511 pm,c=397 pm;標準狀況下氫氣的密度為8.98×10-5 g·cm-3;儲氫能力=![]() 。若忽略吸氫前后晶胞的體積變化,則該儲氫材料的儲氫能力為_______。
。若忽略吸氫前后晶胞的體積變化,則該儲氫材料的儲氫能力為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有短周期元素X形成的單質A與NaOH溶液反應,有如下轉化關系![]() ,(若產物中有水生成則省略未表示出來)。
,(若產物中有水生成則省略未表示出來)。
(1)若常溫常壓下,A為氣態,且B、C中均有X元素,則A與NaOH溶液反應的離子方程式為 ;
(2)若常溫常壓下,A為非金屬固態單質,且其在電子工業中有著重要的用途,則工業制取A化學方程式為 ;
(3)若A為金屬,C為氣體,則A 與NaOH溶液反應的離子方程式為
(4)由(2)和(3)中兩種單質形成合金在工業、建筑業中有重要的用途。一個探究性學習小組,他們擬
用該合金與足量稀硫酸的反應測定通常狀況下氣體摩爾體積,實驗裝置如下:
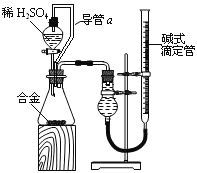
①裝置中導管a的作用是平衡分液漏斗上下管口的壓強,有利于液體滴下和 ;
②實驗中準確測得4個數據:實驗前該合金的質量m1g,實驗后殘留固體的質量m2g,實驗前后堿式滴定管中液面讀數分別為V1mL、V2mL;則通常狀況時氣體摩爾體積Vm=_____L·moL-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知298 K時,合成氨反應:N2(g)+3H2(g)![]() 2NH3(g),生成2 mol NH3放出92.4 kJ熱量。在該溫度下,取1 mol N2(g)和3 mol H2(g)在體積為2L的密閉容器中充分反應,放出的熱量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
2NH3(g),生成2 mol NH3放出92.4 kJ熱量。在該溫度下,取1 mol N2(g)和3 mol H2(g)在體積為2L的密閉容器中充分反應,放出的熱量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
如果反應5分鐘達到平衡時氣體總物質的量為2.5mol,則這段時間內氫氣的反應速率為 ,達平衡時氮氣的轉化率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[化學—選修3:物質結構與性質] 化學作為一門基礎自然科學,在材料科學、生命科學、能源科學等諸多領域發揮著重要作用。
(1)高溫超導材料釔鋇銅氧的化學式為YBaCu3O7,其中1/3的Cu以罕見的Cu3+形式存在。Cu在元素周期表中的位置為____ ,基態Cu3+的核外電子排布式為_ _______。
(2)磁性材料在生活和科學技術中應用廣泛。研究表明,若構成化合物的陽離子有未成對電子時,則該化合物具有磁性。下列物質適合作錄音磁帶磁粉原料的為____(填選項字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
(3)屠呦呦因在抗瘧藥——青蒿素研究中的杰出貢獻,成為首獲科學類諾貝爾獎的中國人。青蒿素的結構簡式如圖l所示,其組成元素的電負性由大到小的順序為 ;碳原子的雜化方式有____ 。
(4)“可燃冰”因儲量大、污染小被視為未來石油的替代能源,由甲烷和水形成的“可燃冰”結構如圖2所示。
①“可燃冰”中分子間存在的2種作用力為 。
②H2O的VSEPR模型為 ,比較鍵角的大小:H2O CH4(填“>”“<”或“=”),原因為 。
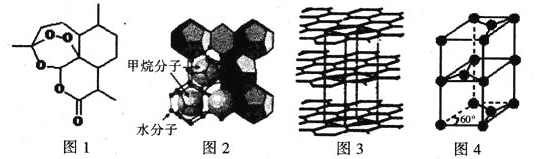
(5)鋰離子電池在便攜式電子設備以及電動汽車、衛星等領域顯示出廣闊的應用前景,該電池負極材料為石墨,石墨為層狀結構(如圖3),其晶胞結構如圖4所示,該晶胞中有 個碳原子。已知石墨的層間距為apm,C-C鍵長為b pm,阿伏伽德羅常數的值為NA,則石墨晶體的密度為 g·cm-3(列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由碳的氧化物直接合成乙醇燃料已進入大規模生產。
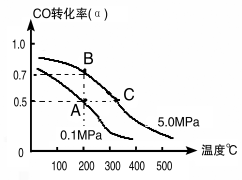
(1)如采取以CO和H2為原料合成乙醇,化學反應方程式:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H;若密閉容器中充有10 mol CO與20mol H2,在催化劑作用下反應生成乙醇,CO的轉化率(α)與溫度、壓強的關系如下圖所示。
CH3CH2OH(g)+H2O(g) △H;若密閉容器中充有10 mol CO與20mol H2,在催化劑作用下反應生成乙醇,CO的轉化率(α)與溫度、壓強的關系如下圖所示。
已知:2CO(g)+O2(g)===2CO2(g) △H1=-566kJ·mol-1
2H2(g)+O2(g)===2H2O(l) △H2=-572kJ·mol-1
CH3CH2OH(g)+3O2(g)===2CO2(g)+ 3H2O(g) △H3=-1366kJ·mol-1
H2O(g)===H2O(l) △H4=-44kJ·mol-1
①△H= kJ·mol-1
②若A、C兩點都表示達到的平衡狀態,則從反應開始到達平衡狀態所需的時間tA tC(填“﹥”、“﹤”或“﹦”)。
③若A、B兩點表示在某時刻達到的平衡狀態,此時在A點時容器的體積為10L,則該溫度下的平衡常數:K= ;
④熔融碳酸鹽燃料電池(MCFS),是用煤氣(CO+H2)作負極燃氣,空氣與CO2的混合氣為正極助燃氣,用一定比例Li2CO3和Na2CO3低熔點混合物做電解質,以金屬鎳(燃料極)為催化劑制成的。負極上CO反應的電極反應式為 。
(2)工業上還可以采取以CO2和H2為原料合成乙醇,并且更被化學工作者推崇,但是在相同條件下,由CO制取CH3CH2OH的平衡常數遠遠大于由CO2制取CH3CH2OH 的平衡常數。請推測化學工作者認可由CO2制取CH3CH2OH的優點主要是: 。
(3)目前工業上也可以用CO2來生產甲醇。一定條件下發生反應CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。若將6mol CO2和8 mol H2充入2L的密閉容器中,測得H2的物質的量隨時間變化的曲線如右圖所示(實線)。
CH3OH(g)+H2O(g)。若將6mol CO2和8 mol H2充入2L的密閉容器中,測得H2的物質的量隨時間變化的曲線如右圖所示(實線)。

①請在答題卷圖中繪出甲醇的物質的量隨時間變化曲線。
②僅改變某一實驗條件再進行兩次實驗,測得H2的物質的量隨時間變化如圖中虛線所示,曲線I對應的實驗條件改變是 ,曲線Ⅱ對應的實驗條件改變是 。
(4)將標準狀況下4.48L CO2通入1L 0.3mol·L-1 NaOH溶液中完全反應,所得溶液中微粒濃度關系正確的是
A.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.c(OH-)+c(CO32-)=c(H2CO3)+c(H+)
C.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某種有機物分子的球棍模型圖。圖中的“棍”代表單鍵或雙鍵,不同大小的“球”代表三種不同的短周期元素的原子。對該有機物的敘述錯誤的是
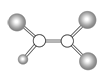
A.該有機物可能的分子式為C2HCl3
B.該有機物的分子中一定有碳碳雙鍵
C.該有機物可以由乙烯和氯化氫加成反應得到
D.該有機物分子中的所有原子在同一平面上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN)是一種新型無機非金屬材料。某A1N樣品僅含有A12O3雜質,為測定AlN的含量,設計如下三種實驗方案。
已知:A1N+NaOH+H2O===NaA1O2+NH3↑
[方案Ⅰ]取一定最的樣品,用以下裝置測定樣品中AlN的純度(夾持儀器已略去)。

(1)上圖C裝置中球形干燥管的作用是________________________;
(2)完成以下實驗步驟:組裝好實驗裝置,首先________________再加入實驗藥品,接下來的實驗操作是______________,打開分液漏斗活塞,加入濃溶液,至不再產生氣體.打開K1,通入氨氣一段時間,測定C裝置反應前后的質量變化通入氮氣的目的是________________________;
(3)由于裝置存在缺陷,導致測定結果偏高,請提出改進意見________________________;
【方案二】
用下圖裝置測定mg樣品中A1N的純度(部分夾持裝置已略去);
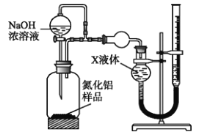
(4)為測定生成氣體的體積,量氣裝置中的X液體可以是_________;
a.CCl4 b.H2O c.NH4Cl溶液 d.![]()
(5)若m g樣品完全反應,測得生成氣體的體積為V mL(已轉換為標準狀況),則A1N的質量分數____________________;
【方案三】
按下圖步驟測定樣品中A1N的純度:
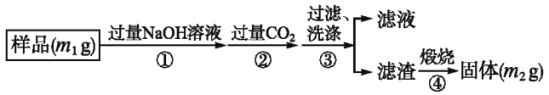
(6)步驟②生成沉淀的離子方程式為________________________;
(7)若在步驟③中未洗滌,測定結果將___________(填“偏高”“偏低’或“無影響”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com