
分析 (1)工業冶煉生鐵的原理反應為Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2;根據反應中生成鐵的質量,可計算參加反應的氧化鐵的質量;
(2)4.80g氧化鐵的物質的量為:$\frac{4.80g}{160g/mol}$=0.03mol,4.80g氧化鐵,當固體質量變成4.56g時,減少氧的物質的量為$\frac{4.80g-4.56g}{16g/mol}$=0.015,所以所得氧化物中氧的物質的量為:0.03×3-0.015=0.075mol,鐵與氧的物質的量之比為:0.03×2:0.075=1:1.25,而Fe3O4中鐵與氧的物質的量之比為:1:1.33,在FeO中鐵與氧的物質的量之比為:1:1,在Fe2O3中鐵與氧的物質的量之比為:1:1.5,所以固體混合物可能是Fe2O3和FeO和Fe3O4和FeO,然后求各自的物質的量;
(3)(1)若鐵與濃硝酸反應生成的完全為二氧化氮,根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,當C為0時生成氣體的量最少,則10g鐵完全反應生成二氧化氮的物質的量為:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以鐵與硝酸反應生成的氣體為NO、NO2的混合物;再根據氣體用50.00mL 12.00mol/L的NaOH溶液(氫氧化鈉遠遠過量)完全吸收后,只生成兩種鹽可知,生成的鹽為碳酸鈉和亞硝酸鈉,說明生成的NO、NO2的物質的量相等,設NO、NO2的物質的量都為x,該碳素鋼中含有C為y,根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC與濃硝酸反應生成ymol二氧化碳、4ymol二氧化氮,鐵與濃硝酸反應生成的二氧化氮為:x-4y,根據反應Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,該鋼中含有鐵的物質的量為:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根據該鋼的質量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,再根據氣體的總物質的量可得:②y+2x=0.3,聯立①②計算出x、y,再計算出該鋼樣的含碳量;
(2)根據(1)計算結果及反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O計算出反應中消耗硝酸的總物質的量.
解答 解:(1)設需要赤鐵礦的質量為x
Fe2O3+3CO$\frac{\underline{\;高溫\;}}{\;}$ 2Fe+3CO2
160 112
x×70% 1t×96%
$\frac{160}{x×70%}=\frac{112}{1t×96%}$,解之得:x=1.96t
答:至少需要70%的赤鐵礦1.96;Fe2O3和FeO 1:2;
(2)4.80g氧化鐵的物質的量為:$\frac{4.80g}{160g/mol}$=0.03mol,4.80g氧化鐵,當固體質量變成4.56g時,減少氧的物質的量為$\frac{4.80g-4.56g}{16g/mol}$=0.015,所以所得氧化物中氧的物質的量為:0.03×3-0.015=0.075mol,鐵與氧的物質的量之比為:0.03×2:0.075=1:1.25,而Fe3O4中鐵與氧的物質的量之比為:1:1.33,在FeO中鐵與氧的物質的量之比為:1:1,在Fe2O3中鐵與氧的物質的量之比為:1:1.5,所以固體混合物可能是Fe2O3和FeO和Fe3O4和FeO,如果是Fe2O3和FeO的混合物,設兩者的物質的量分別為:xmol,ymol,則$\frac{1.5x+y}{x+y}=1.25$,解之得$\frac{x}{y}=\frac{1}{2}$;如果是Fe3O4和FeO的混合物,解得兩的物質的量之比為:1:1,答:Fe2O3和FeO的混合物,兩者之比為1:2;或者Fe3O4和FeO的混合物,兩的物質的量之比為:1:1;
(3)(1)若鐵與濃硝酸反應生成的完全為二氧化氮,根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20、Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O可知,當C為0時生成氣體的量最少,則10g鐵完全反應生成二氧化氮的物質的量為:$\frac{10g}{56g/mol}$×3≈0.536mol>0.300mol,所以鐵與硝酸反應生成的氣體為NO、NO2的混合物;再根據氣體用50.00mL 12.00mol/L的NaOH溶液(氫氧化鈉遠遠過量)完全吸收后,只生成兩種鹽可知,生成的鹽為碳酸鈉和亞硝酸鈉,說明生成的NO、NO2的物質的量相等,設NO、NO2的物質的量都為x,該碳素鋼中含有C為y,
根據反應C+4HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H20可知,ymolC與濃硝酸反應生成ymol二氧化碳、4ymol二氧化氮,
鐵與濃硝酸反應生成的二氧化氮為:x-4y,根據反應Fe+6HNO3(濃)$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+3NO2↑+3H2O、Fe+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Fe(NO3)3+NO↑+2H2O可知,該鋼中含有鐵的物質的量為:$\frac{3}{2}$x+$\frac{1}{3}$(x-4y),根據該鋼的質量可得:①[x+$\frac{1}{3}$(x-4y)]×56+12y=10.00,再根據氣體的總物質的量可得:②y+2x=0.3,聯立①②解得:x=0.144mol、y=0.012mol,
即:該鋼中含有0.012molC,其含碳量為:$\frac{12g/mol×0.012mol}{10.00g}$×100%=1.44%,
答:該鋼樣的含碳量為1.44%;
(2)0.012molC消耗硝酸的物質的量為:0.012mol×4=0.048mol,
生成0.144molNO消耗硝酸的物質的量為:0.144mol×4=0.576mol,
鐵與濃硝酸反應生成二氧化氮的物質的量為:0.144mol-0.012mol×4=0.096mol,反應生成0.096mol二氧化氮消耗硝酸的物質的量為:0.096mol×$\frac{6}{3}$=0.192mol,
所以反應中消耗硝酸的總物質的量為:0.048mol+0.576mol+0.192mol=0.816mol,
答:參加反應的硝酸的物質的量為0.816mol.
點評 本題考查使用化學方程式進行計算和混合物反應的計算,題目難度較大,學生注意代入化學方程式的量一定是純凈物的質量,不能把混合物的質量直接代入化學方程式進行計算,下面兩個題目根據生成氣體的量及生成兩種鹽判斷反應氣體組成及生成固體的組成為解答關鍵,注意明確一氧化氮、二氧化氮與氫氧化鈉溶液的反應原理,試題側重考查學生的分析、理解能力.


科目:高中化學 來源: 題型:選擇題
| A. | 室溫時,NaHA溶液pH<7,是由于HA-的電離程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向兩份等體積NaHA、Na2A的濃度比為1:1的混合溶液中分別加入適當濃度的鹽酸與氫氧化鈉,其pH隨加入酸、堿量的變化圖象為: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
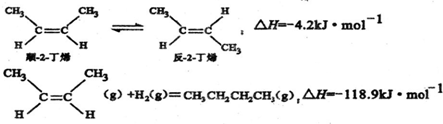
| A. | 反-2-丁烯比順-2-丁烯穩定 | |
| B. | 順-2-丁烯的燃燒熱數值比反-2-丁烯小 | |
| C. | 減壓和升溫有利于平衡向生成正丁烷反應方向移動 | |
| D. | 反-2-丁烯氫化的熱化學方程式為: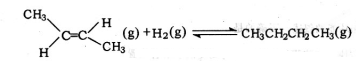 △H=-123.1kJ•mol-1 △H=-123.1kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 甲、乙、丙三種物質均含有鋁元素,在溶液中的轉化關系如圖所示.下列說法正確的是( )
甲、乙、丙三種物質均含有鋁元素,在溶液中的轉化關系如圖所示.下列說法正確的是( )| A. | 若甲是Al,丙是Al(NO3)3,則乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,則乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,則乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,則乙一定是NaAlO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
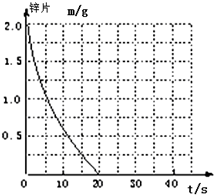 興趣小組探究鋅片與鹽酸、醋酸反應時,濃度或溫度對反應速率的影響,他們準備了以下化學用品:0.20mol/L與0.40mol/L的HCl溶液、0.2mol/L與0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、鋅片(形狀、大小、質量相同)、秒表、碳棒、導線、燒杯、幾支試管和膠頭滴管,酸液溫度控制為298K和308K.
興趣小組探究鋅片與鹽酸、醋酸反應時,濃度或溫度對反應速率的影響,他們準備了以下化學用品:0.20mol/L與0.40mol/L的HCl溶液、0.2mol/L與0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、鋅片(形狀、大小、質量相同)、秒表、碳棒、導線、燒杯、幾支試管和膠頭滴管,酸液溫度控制為298K和308K.| 實驗編號 | 溫度(K) | 鹽酸濃度 | 醋酸濃度 | 實驗目的 |
| ① | 298 | 0.20mol/L | / | a.實驗①和②是探究不同溫度對鋅與鹽酸反應速率的影響; b.實驗①和③是探究不同濃度對鋅與鹽酸反應速率的影響; c.實驗①和④是探究相同溫度下,相同濃度的鹽酸、醋酸與鋅反應速率的區別. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
| 實驗步驟 | 預期現象 |
| ①將不連接的銅、鋅電極插入稀硫酸中,②將銅、鋅電極用導線連接放入稀硫酸中 | 產生氫氣的速率②大于①,證明構成原電池后可以大大加快反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
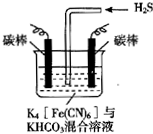 [Fe(CN)6]3-可將氣態廢棄物中的硫化氫轉化為可利用的硫,自身還原為[Fe(CN)6]4-.工業上常采用如圖所示的電解裝置,通電電解,然后通入H2S加以處理.下列說法不正確的是( )
[Fe(CN)6]3-可將氣態廢棄物中的硫化氫轉化為可利用的硫,自身還原為[Fe(CN)6]4-.工業上常采用如圖所示的電解裝置,通電電解,然后通入H2S加以處理.下列說法不正確的是( )| A. | 電解時陽極反應式為[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 電解時陰極反應式為2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 當電解過程中有22.4L標準狀況下的H2生成時,溶液中有32gS析出(溶解忽略不計) | |
| D. | 整個過程中需要不斷補充K4[Fe(CN)6]與KHCO3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com