
【題目】有50mLNaOH溶液,向其中逐漸通入一定量的CO2,隨后取此溶液10mL將其稀釋到100mL,并向此稀釋后的溶液中逐滴加入0.1mol/L的HCl溶液,產生的CO2氣體體積(標況)與所加入的鹽酸的體積之間的關系如下圖所示:
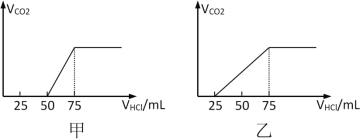
試分析NaOH在吸收CO2氣體后,在甲、乙兩種情況下,所得溶液中存在的溶質是什么?其物質的量之比是多少?__________產生的CO2氣體體積(標況)是多少?____________
【答案】NaOH、Na2CO3 1:1;Na2CO3、NaHCO3 1:1; 56mL;112mL
【解析】
當生成CO2氣體時,發生反應NaHCO3+HCl=NaCl+H2O+CO2↑。
(1)(甲)中生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,中和NaOH消耗HCl的體積為50mL-25mL=25mL,根據反應消耗鹽酸的體積計算NaOH、Na2CO3的物質的量之比;
(乙)中生成CO2氣體至最大,消耗HCl為50mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為50mL,而圖象中開始生成CO2氣體時消耗HCl體積為25mL,說明該階段只發生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳與NaOH反應后溶液中含NaHCO3、Na2CO3,根據反應消耗鹽酸的體積計算NaHCO3、Na2CO3的物質的量之比;
(2)根據碳元素守恒可知,(甲)中從50mL~75mL消耗25mL鹽酸時生成的二氧化碳,而(乙)中從25mL~75mL消耗50mL鹽酸時生成的二氧化碳,根據方程式進而計算生成二氧化碳的體積。
(1)(甲)中生成CO2氣體至最大,消耗HCl為25mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為25mL,而圖象中開始生成CO2氣體時消耗HCl體積為50mL,說明該階段還發生反應NaOH+HCl=NaCl+H2O,溶液中溶質為NaOH、Na2CO3,中和NaOH消耗HCl的體積為50mL-25mL=25mL,由方程式可知NaHCO3和Na2CO3的物質的量之比等于兩個過程分別消耗鹽酸的體積之比,故NaOH、Na2CO3的物質的量之比=25mL:25mL=1:1;(乙)中生成CO2氣體至最大,消耗HCl為50mL,若二氧化碳與NaOH反應后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,將CO32-轉化為HCO3-應消耗HCl為50mL,而圖象中開始生成CO2氣體時消耗HCl體積為25mL,說明該階段只發生Na2CO3+HCl=NaHCO3+NaCl,且二氧化碳與NaOH反應后溶液中含NaHCO3、Na2CO3, Na2CO3轉化為NaHCO3消耗鹽酸體積為25mL,則原溶液中NaHCO3消耗鹽酸體積50mL-25mL=25mol,故NaHCO3、Na2CO3的物質的量之比=25mL:25mL=1:1,故答案為:NaOH、Na2CO3,1:1;NaHCO3、Na2CO3,1:1;
(2)根據碳元素守恒可知,(甲)中從50mL~75mL消耗25mL鹽酸時生成的二氧化碳,該階段生成二氧化碳為0.025L×0.1mol·L-1=0.0025mol,體積為0.0025mol×22.4L·mol-1=0.056L=56mL,而(乙)中從25mL~75mL消耗50mL鹽酸時生成的二氧化碳,該階段生成二氧化碳為0.05L×0.1mol·L-1=0.005mol,體積為0.005mol×22.4L·mol-1=0.112L=112mL,故答案為:56;112。


科目:高中化學 來源: 題型:
【題目】信息時代產生的大量電子垃圾對環境構成了極大的威脅。某“變廢為寶”學習探究小組將一批廢棄的線路板簡單處理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金屬的混合物,并設計出如下制備硫酸銅和硫酸鋁晶體的路線:
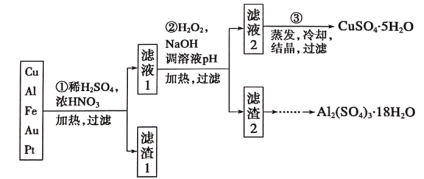
請回答下列問題:
(1)第①步Cu與酸反應的離子方程式為_________;
得到濾渣I的主要成分為____________________;
(2)第②步加H2O2的作用是__________________;
(3)用第③步所得CuSO4·5H2O制備無水CuSO4的方法是________;
(4)由濾渣2制取Al2(SO4)3·18H2O,探究小組設計了三種方案:
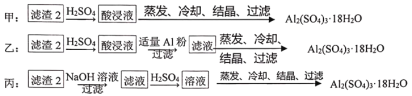
上述三種方案中,___方案不可行,原因是_____;從原子利用率角度考慮,___方案更合理。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有部分元素的性質與原子![]() 或分子
或分子![]() 結構如表所示:
結構如表所示:
元素編號 | 元素性質與原子 |
T | 最外層電子數是次外層電子數的3倍 |
X | 常溫下單質分子為雙原子分子,分子中含有3對共用電子對 |
Y | M層比K層少1個電子 |
Z | 第三周期元素的金屬離子中半徑最小 |
(1)畫出元素T的原子結構示意圖:__。
(2)元素Y與元素Z相比,金屬性較強的是__![]() 用元素符號表示
用元素符號表示![]() ,下列表述中能證明這一事實的是___
,下列表述中能證明這一事實的是___![]() 填字母
填字母![]() 。
。
a.Y單質的熔點比Z單質低
b.Y的化合價比Z低
c.Y單質與水反應比Z單質與水反應劇烈
d.Y最高價氧化物對應的水化物的堿性比Z的強
(3)T、X、Y、Z中的兩種元素能形成既有離子鍵又有非極性共價鍵的化合物,寫出該化合物的化學式:__。
(4)T可以形成穩定的陰離子Tm-,Y可以形成穩定的陽離子Yn+,其半徑關系為r(Tm-)__r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高價氧化物對應的水化物可以相互發生反應,寫出Y、Z的最高價氧化物對應的水化物之間反應的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有![]() 、
、![]() 、
、![]() 、
、![]() 四種元素,
四種元素,![]() 元素是地殼中含量最多的金屬元素;
元素是地殼中含量最多的金屬元素;![]() 元素的原子其
元素的原子其![]() 層(有電子)電子數比
層(有電子)電子數比![]() 層少1;
層少1;![]() 元素的原子得到2個電子和
元素的原子得到2個電子和![]() 元素的原子失去1個電子所得到的微粒都具有與氖原子相同的電子層結構。回答下列問題:
元素的原子失去1個電子所得到的微粒都具有與氖原子相同的電子層結構。回答下列問題:
(1)上述四種元素中![]() 元素的名稱是______。
元素的名稱是______。
(2)畫出![]() 元素原子的結構示意圖:____________。
元素原子的結構示意圖:____________。
(3)寫出下列化學方程式。
①單質![]() 在單質
在單質![]() 中燃燒:__________________;
中燃燒:__________________;
②![]() 的氫氧化物和
的氫氧化物和![]() 的氫氧化物在溶液中反應:________________________。
的氫氧化物在溶液中反應:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物質的量與加入NaOH的物質的量關系如圖所示,則原溶液中Cl- 與SO42-的物質的量之比為

A. 1:3B. 1:6
C. 2:3D. 3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種短周期元素,原子半徑的大小關系為![]() ,原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生如圖所示變化,其中B和C均為10電子分子。下列說法不正確的是( )
,原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生如圖所示變化,其中B和C均為10電子分子。下列說法不正確的是( )
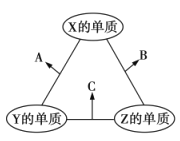
A.X元素位于ⅥA族
B.A不能溶解于B中
C.B的穩定性強于C
D.A和C不可能發生氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】胡蘿卜中具有較多的胡蘿卜素,它是人體主要營養之一,α-胡蘿卜素的結構為: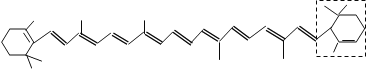 。有機化學中有時可以將結構簡式中的C和H省略不寫,如
。有機化學中有時可以將結構簡式中的C和H省略不寫,如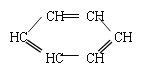 可寫為:
可寫為:![]() ;又如
;又如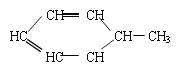 可寫為:
可寫為:![]() 。
。
(1)寫出α-胡蘿卜素的化學式______________。
(2)1mol胡蘿卜素最多能與__________molBr2發生加成反應。
(3)β-胡蘿卜素與α-胡蘿卜素互為同分異構體,且只是虛線框內部分不同,但碳架結構相同,寫出β-胡蘿卜素虛線框內可能的結構簡式___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 為短周期元素,且原子序數依次遞增。
為短周期元素,且原子序數依次遞增。![]() 、
、![]() 同主族,
同主族,![]() 、
、![]() 同主族。
同主族。![]() 與其他非金屬元素化合時易形成共價鍵,
與其他非金屬元素化合時易形成共價鍵,![]() 與其他非金屬元素化合時易形成離子鍵,且離子
與其他非金屬元素化合時易形成離子鍵,且離子![]() 與
與![]() 的核外電子排布相同。氣態分子
的核外電子排布相同。氣態分子![]() 和
和![]() 具有相同的電子數,
具有相同的電子數,![]() 是空氣中含量最高的物質。請回答下列問題:
是空氣中含量最高的物質。請回答下列問題:
(1)![]() 位于第______周期______族;
位于第______周期______族;
(2)![]() 的簡單離子結構示意圖為______;
的簡單離子結構示意圖為______;
(3)![]() 的電子式是______;
的電子式是______;
(4)由![]() 、
、![]() 、
、![]() 三種元素形成的化合物的化學式為______,含有的化學鍵類型有______,屬于______(填“共價”或“離子”)化合物。
三種元素形成的化合物的化學式為______,含有的化學鍵類型有______,屬于______(填“共價”或“離子”)化合物。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予在開發鋰離子電池方面做出卓越貢獻的三位化學家。鋰離子電池的廣泛應用要求處理鋰電池廢料以節約資源、保護環境。鋰離子二次電池正極鋁鈷膜主要含有LiCoO2、A1等,處理該廢料的一種工藝如下圖所示:

回答下列問題:
(l) Li的原子結構示意圖為____,LiCoO2中Co的化合價是____。
(2)“堿浸”時Al溶解的離子方程式為________。
(3)“酸溶”時加入H2O2的目的是____,調節pH后所得濾渣主要為____。
(4)“沉鈷”的離子方程式為________。
(5)配制100mL l.0mol/L (NH4)2C2O4溶液,需要的玻璃儀器除玻璃棒、燒杯外,還需要____。
(6)取CoC2O4固體4.41g在空氣中加熱至300℃,得到鈷的氧化物2.41g,則該反應的化學方程式為____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com