
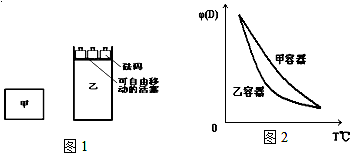
| A. | 甲容器中的反應先達到化學平衡狀態 | |
| B. | 兩容器中反應均達平衡后,平衡體系中各組分的體積百分組成相同,濃度也相同 | |
| C. | 兩容器達平衡后升高相同的溫度,兩容器中物質D的體積分數隨溫度變化如圖2所示 | |
| D. | 在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍 |
分析 據題意可知,該反應前后氣體的物質的量不變,乙中的氣體的物質的量是甲中的兩倍,體積也是兩倍,且溫度相同,將乙容器中的物質全部轉化為A、B得出甲容器的濃度與乙容器一樣,所以甲與乙完全等效,利用等效平衡分析各個選項即可.
解答 解:A、雖然等效平衡后甲、乙容器中A、B濃度相等,但是該反應一個是從正反應進行,一個從逆反應進行,所以無法判斷哪個容器先達平衡,故A錯誤;
B、等效平衡后甲、乙容器中A、B濃度相等,反應前后氣體體積不變,壓強不變,所以平衡混合物中各組分的體積百分組成相同,混合氣體的平均相對分子質量也相同,故B正確;
C、△H<0,該反應是放熱反應,兩容器中的反應均達平衡時,升高相同的溫度,平衡向逆反應方向移動,物質D的體積分數隨溫度的升高而降低.因為平衡混合物中各組分的體積百分組成相同,所以兩容器中物質D的體積分數隨溫度變化應該用同曲線表示,故C錯誤;
D、向甲容器中再充入2molA和2molB,等效為再甲中平衡基礎上,增大1倍壓強,體積縮小一倍,平衡不移動,反應物轉化率不變,平衡后甲中物質C的濃度加倍,所以向甲容器中再充入2molA和2molB,平衡后甲容器中物質C的濃度是乙容器中物質C的濃度的2倍,故D正確;
故選BD.
點評 本題考查化學平衡的影響因素、等效平衡等,理解等效平衡是解本題的關鍵,但本題又是一個反應前后氣體體積不變的反應,所以解題時應注意分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
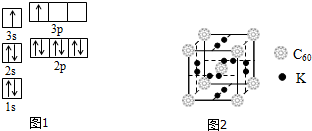
| 電離能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a>b | B. | a<2b | C. | a=b | D. | 2a=b |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去Na2CO3 固體中混有的少量的NaHCO3:置于坩堝中加熱 | |
| B. | 除去FeCl2溶液中的FeCl3:加入鐵粉 | |
| C. | 除去氫氧化鐵膠體中所含的鹽酸:過濾 | |
| D. | 除去CO2中混有的少量的HCl:通過飽和的NaHCO3溶液中洗氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入少量 W,逆反應速率增大 | |
| B. | 升高溫度,平衡逆向移動 | |
| C. | 平衡后加入 X,上述反應的△H增大 | |
| D. | 當容器中氣體壓強不變時,反應達到平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol乙醇燃燒生成3 mol水 | |
| B. | 乙醇可以制飲料 | |
| C. | 1 mol乙醇跟足量的Na作用得0.5 mol H2 | |
| D. | 乙醇代替汽油做燃料,污染小,更環保 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 利用如圖裝置進行實驗,開始時,a、b兩處液面相平,密封好,放置一段時間.下列說法不正確的是( )
利用如圖裝置進行實驗,開始時,a、b兩處液面相平,密封好,放置一段時間.下列說法不正確的是( )| A. | a處溶液的pH增大,b處溶液的pH減小 | |
| B. | 一段時間后,a管液面高于b管液面 | |
| C. | a管發生吸氧腐蝕,b管發生析氧腐蝕 | |
| D. | a、b兩處具有相同的電極反應式:Fe-2e-=Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com