
【題目】磷化鋁(AlP)和磷化氫(PH3)都是糧食儲備常用的高效熏蒸殺蟲劑。
(1)磷元素在元素周期表中的位置:________________。AlP遇水蒸氣會發生反應放出PH3氣體,該反應的另一種產物的化學式為________。
(2)PH3具有強還原性,能與CuSO4溶液反應,配平該反應的化學方程式:
________CuSO4+_____PH3+_____H2O=_____Cu3P↓+_____H3PO4+_____H2SO4
(3)工業制備PH3的流程如圖所示。

①次磷酸屬于________元酸。
②白磷和燒堿溶液反應的化學方程式為:____________________________________。
③若起始時有1 mol P4參加反應,則整個工業流程中共生成________mol PH3。(不考慮產物的損失)
【答案】第3周期第VA族 Al(OH)3 24 11 12 8 3 24 1 P4 + 3NaOH + 3H2O=PH3↑+ 3NaH2PO2 2.5
【解析】
(1)原子結構中電子層數等于周期數,最外層電子數等于族序數,AlP遇水蒸氣會發生反應放出PH3氣體,根據元素守恒確定該反應的另一種產物的化學式;
(2)配平化學方程式,就是通過在各物質的化學式前面添加系數,使反應中每種原子個數在反應前后相等的過程,但對于復雜的化學反應通常通過觀察,找出變化的特點或規律,常使用化合價來配平,保證化合價升高與降低的數相等即可;
(3)①根據物質電離出的氫離子數目確定酸的元數;
②根據圖示信息:白磷和燒堿溶液反應生成PH3、NaH2PO2,據此書寫方程式;
③根據發生反應的過程尋找關系式,進行計算即可。
(1)P處于第3周期ⅤA族,AlP遇水蒸氣會發生反應放出PH3氣體,根據元素守恒,確定該反應的另一種產物是Al(OH)3,故答案為:第3周期第VA族;Al(OH)3;
(2)該方程式中Cu價態由+2下降為+1,P價態由-3升高為+5,為保證化合價升降數相等,Cu3P與H3PO4計量數分別為8、3,CuSO4的系數是24,H2SO4系數是24,根據元素守恒,得到:![]() ,故答案為:24,11,12,8,3,24;
,故答案為:24,11,12,8,3,24;
(3)①根據氫氧化鈉過量時只能生成NaH2PO2可知次磷酸只能電離出1個氫離子,因此次磷酸屬于一元酸,故答案為:1;
②根據圖示信息:白磷和燒堿溶液反應生成PH3、NaH2PO2,方程式為:![]() ;故答案為:
;故答案為:![]() ;
;
③P4+3NaOH+3H2O=PH3↑+3NaH2PO2;2H3PO2=PH3↑+H3PO4,即P4~2.5PH3,若起始時有1molP4參加反應,則整個工業流程中共生成2.5molPH3;故答案為:2.5。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
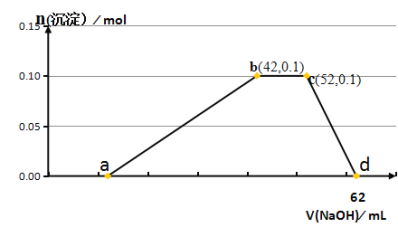
【題目】某研究小組取50g含十二水硫酸鋁銨〔NH4Al(SO4)2·12H2O俗稱鋁銨礬〕的樣品投入200mL稀硫酸中,待固體全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量(n)與加入NaOH溶液的體積(V)的關系如圖所示:
(假設鋁銨礬中的雜質不溶于H2SO4,也不溶于NaOH)
請回答下列問題:
(1)cd段反應的離子方程式是___;
(2)圖中b點溶液中的溶質有___;
(3)鋁銨礬溶于水時的電離方程式是___;
(4)H2SO4的物質的量的濃度為___;
(5)該樣品中鋁銨礬的質量分數為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,已知有機物A的相對分子質量是28,它的產量是衡量一個國家石油化工水平的標志,B和D都是日常生活食品中常見的有機物,F是一種高聚物,生活中用于制造食物保鮮膜。
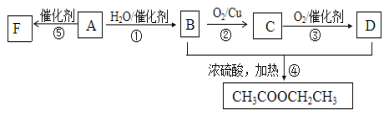
(1)請寫出A的分子式:_____________。
(2)請寫出下列反應的類型:④_____________,⑤_____________。
(3)請寫出下列反應的化學方程式:
①_____________;⑤_____________;
(4)某實驗小組用下列裝置模擬上述反應②的轉化過程。
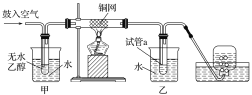
實驗過程中銅網出現黑色和紅色交替的現象。
①紅色變成黑色的反應是2Cu+O2![]() 2CuO;
2CuO;
②黑色變為紅色的化學方程式為____________________________________________。甲和乙兩個水浴作用不相同,甲的作用是________(填“加熱”或“冷卻”);反應進行一段時間后,試管a中能收集到多種物質,它們是______(任寫兩種即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩燒杯中各盛有100 mL 3 mol·L-1的鹽酸和氫氧化鈉溶液,向兩燒杯中分別加入等質量的鋁粉,反應結束后生成的氣體的體積比為甲∶乙=1∶2,則加入鋁粉的質量為( )
A.5.4 gB.3.6 gC.2.7 gD.1.8 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是部分短周期元素原子半徑與原子序數的關系圖。則下列說法正確的是
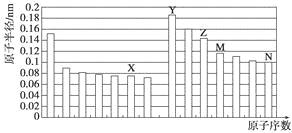
A. Z、N兩種元素的離子半徑相比,前者較大
B. X、N兩種元素的氣態氫化物的沸點相比,前者較低
C. 由X與M兩種元素組成的化合物不能與任何酸反應,但能與強堿反應
D. Z的氧化物能分別溶解于Y的氫氧化物和N的氫化物的水溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鹽與鉆形成的一種配合物1Co(NH3)5N02]C12的制備流程如下:
CoC12·6H20![]() [Co(NH3)5C1]C12
[Co(NH3)5C1]C12![]() [Co(NH3)5NO2]C12
[Co(NH3)5NO2]C12
(1)Co2+基態核外電子排布式為_______________。
(2)配合物[Co(NH3)5C1]C12中與Co3+形成配位鍵的原子為___________(填元素符號);配離子[Co(NH3)5N02]2+的配體中氮原子的雜化軌道類型為___________。
(3)與NO2-互為等電子體的單質分子為___________(寫化學式)。
(4)H202與H20可以任意比例互溶,除因為它們都是極性分子外,還因為 _______________。
(5)亞硝酸鹽在水體中可轉化為強致癌物亞硝胺,亞硝胺NDMA的結構、簡式如圖所示,lmolNDMA分子中含有![]() 鍵的數目為______________mol.
鍵的數目為______________mol.
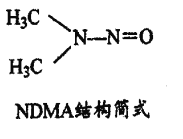
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述正確的是
4NO(g)+6H2O(g),下列敘述正確的是
A.達到化學平衡時,4v正(O2) = 5v逆(NO)
B.若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C.達到化學平衡時,若增加容器體積,則正反應速率減小,逆反應速率增大
D.化學反應速率關系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由硫鐵礦“燒渣”(主要成分:Fe3O4、Fe2O3和FeO)制備綠礬(FeSO4·7H2O))的流程如圖:

已知:FeS2(S的化合價為-1)難溶于水。
(1)①中加入的酸為___,濾渣2的主要成分是___。
(2)①中生成Fe3+的離子方程式為Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)檢驗②中Fe3+已經完全轉化成Fe2+的實驗方法:取適量溶液2,___。
(4)通過③得到綠礬晶體的實驗操作:加熱濃縮、冷卻結晶、___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學院科研團隊研究表明,在常溫常壓和可見光下,基于LDH(一種固體催化劑)合成NH3的原理示意圖如下。下列說法不正確的是( )
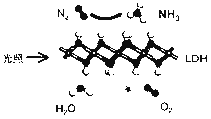
A. 該過程將太陽能轉化成為化學能 B. 該過程中,涉及極性鍵與非極性鍵的斷裂與生成
C. 氧化產物與還原產物的物質的量之比為3∶4 D. 該反應為放熱反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com