
反應Fe + H2SO4 == FeSO4 + H2↑的能量變化趨勢,如下圖所示:
(1)該反應為 反應(填“吸熱”或“放熱”)
(2)若要使該反應的反應速率加快,下
![]() 列措施可行的是 (填字母) 反應物總能量
列措施可行的是 (填字母) 反應物總能量
a、改鐵片為鐵粉
b、改稀H2SO4為98%的濃H2SO4
![]()
![]() c、升高溫度
c、升高溫度
(3)若將上述反應設計成原電池,銅為 生成物總能量
原電池某一極材料,則銅為 極(填“正”或“負”)。銅片上產生的現象為 ,該極上發生的電極反應為 ,外電路中電子由 極(填“正”或“負”下同)向 移動。
科目:高中化學 來源: 題型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2013屆浙江省杭州市高三上學期期中七校聯考化學試卷(帶解析) 題型:單選題
化學方程式可簡明地體現元素及其化合物的性質。已知:
氧化還原反應:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的復分解反應:(Se元素的原子序數為34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
熱分解反應:
BaCO3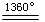 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3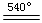 MgO+ CO2↑;CuCO3
MgO+ CO2↑;CuCO3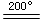 CuO+ CO2↑
CuO+ CO2↑
下列說法不正確的是
| A.氧化性(酸性溶液):PbO2>Fe3+>S |
| B.還原性(堿性溶液):Fe(OH)2>KCl>Cl2 |
| C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D.熱穩定性:CaCO3>FeCO3>Ag2CO3 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年廣西北海市合浦縣高一上學期期中考試化學試卷(解析版) 題型:選擇題
下列離子方程式書寫正確的是
A.碳酸鈣與鹽酸反應 CO32-+2H+=CO2↑+H2O
B.硫酸和氯化鋇溶液反應 Ba2++SO42-=BaSO4↓
C.氫氧化鈉和少量氫硫酸反應 OH-+H2S=S2-+H2O
D.鐵釘放入硫酸銅溶液中 Fe+3Cu2+=2Fe3++3Cu
查看答案和解析>>
科目:高中化學 來源:2012-2013學年浙江省杭州市高三上學期期中七校聯考化學試卷(解析版) 題型:選擇題
化學方程式可簡明地體現元素及其化合物的性質。已知:
氧化還原反應:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的復分解反應:(Se元素的原子序數為34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
熱分解反應:
BaCO3 BaO+CO2↑;MgCO3
BaO+CO2↑;MgCO3 MgO+
CO2↑;CuCO3
MgO+
CO2↑;CuCO3 CuO+
CO2↑
CuO+
CO2↑
下列說法不正確的是
A.氧化性(酸性溶液):PbO2>Fe3+>S
B.還原性(堿性溶液):Fe(OH)2>KCl>Cl2
C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3
D.熱穩定性:CaCO3>FeCO3>Ag2CO3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com