
| A. | c(OH-)前者大于后者 | |
| B. | 與同濃度的鹽酸反應時的反應速率前者大于后者 | |
| C. | 分別加入1L的0.2 mol/L的HNO3 后一定產生4.48LCO2 | |
| D. | 溶液中陽離子濃度相同 |
分析 A、CO32-的水解程度遠遠大于HCO3-水解程度;水解規律:誰強顯誰性;
B、碳酸氫鈉可以和鹽酸直接反應得到二氧化碳氣體,但是碳酸鈉和鹽酸反應先是轉化為碳酸氫根離子,然后放出二氧化碳;
C、分別加入1L的0.2 mol/L的HNO3后,碳酸氫鈉可以和酸直接反應得到二氧化碳氣體,但是碳酸鈉和酸反應先是轉化為碳酸氫根離子,然后放出二氧化碳,據此計算;
D、碳酸根離子的水解程度大于碳酸氫根離子的水解程度,據此回答.
解答 解:A、CO32-的水解程度遠遠大于HCO3-水解程度,二者水解均顯堿性,根據水解規律:誰強顯誰性,所以Na2CO3中的氫氧根濃度大于NaHCO3溶液中的氫氧根濃度,故A錯誤;
B、碳酸氫鈉可以和鹽酸直接反應得到二氧化碳氣體,但是碳酸鈉和鹽酸反應先是轉化為碳酸氫根離子,然后放出二氧化碳,所以濃度均為0.2mol/L的NaHCO3和Na2CO3溶液與同濃度的鹽酸反應時的反應速率前者大于后者,故B正確;
C、濃度均為0.2mol/L的NaHCO3和Na2CO3溶液,分別加入1L的0.2 mol/L的HNO3后,產生二氧化碳的量取決于碳酸鈉、碳酸氫鈉的濃度以及體積的大小,故C錯誤;
D、碳酸根離子的水解程度大于碳酸氫根離子的水解程度,所以碳酸鈉中氫離子濃度小于碳酸氫鈉中氫離子濃度,二者的溶液中鈉離子濃度是一樣的,所以溶液中陽離子濃度是碳酸氫鈉溶液中更大,故D錯誤.
故選B.
點評 本題考查鹽的水解的應用,明確水解原理及鹽類水解規律的應用是解題的關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 相同溫度下兩種溶液的pH:Na2CO3>NaHCO3 | |
| B. | 若分別升高溫度,兩種溶液的pH均減小 | |
| C. | 若分別加入少量NaOH,兩溶液中c(CO32-)均增大 | |
| D. | 兩溶液中的離子濃度均存在關系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硅不與任何酸反應,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有還原性,可用于自來水的殺菌消毒 | |
| C. | 常溫下濃硫酸使鋁鈍化,可在常溫下用鋁制貯罐貯運濃硫酸 | |
| D. | 二氧化氮溶于水時只生成唯一產物硝酸,工業上利用這一原理生產硝酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
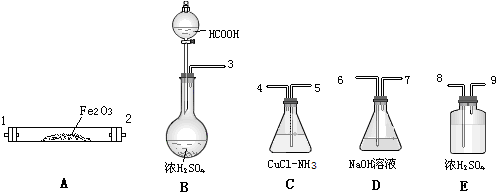
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
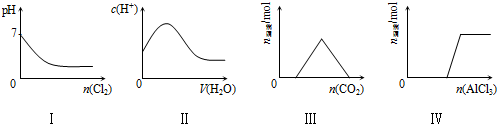
| A. | I表示向Na2SO3溶液中通入Cl2 | |
| B. | II表示向純CH3COOH中逐滴加水并不斷振蕩 | |
| C. | III表示向KOH和Ca(OH)2混合液中通入CO2 | |
| D. | Ⅳ表示向NaOH溶液中逐滴加入AlCl3溶液并不斷振蕩 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
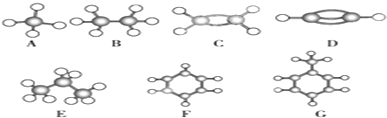
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com