
【題目】已知,常溫下CH3COOH和NH3·H2O的電離常數均為1.8×10-5。某小組進行如圖三組實驗且實驗II、III中Mg(OH)2固體均溶解。下列說法正確的是
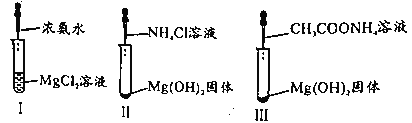
A.I中現象說明NH3·H2O堿性強于Mg(OH)2
B.II中總反應為2H++Mg(OH)2=Mg2++2H2O
C.實驗II、III研究NH4+對Mg(OH)2溶解的作用原理
D.III中CH3COONH4濃度越小,越有利于沉淀的溶解
【答案】C
【解析】
A項、NH3·H2O為弱堿,Mg(OH)2為中強堿,NH3·H2O堿性弱于Mg(OH)2,故A正確;
B項、Mg(OH)2能夠溶于呈酸性的氯化銨溶液和呈中性的醋酸銨溶液,說明NH4+結合Mg(OH)2電離出的OH-,使Mg(OH)2的溶解平衡正向移動,II中總反應為2NH4++Mg(OH)2=Mg2++2NH3·H2O,故B錯誤;
C項、實驗II、III中Mg(OH)2能夠溶于呈酸性的氯化銨溶液和呈中性的醋酸銨溶液,說明Mg(OH)2溶解不是與氫離子發生反應,反應原理是NH4+結合Mg(OH)2電離出的OH-,使Mg(OH)2的溶解平衡正向移動,導致Mg(OH)2溶解,故C正確;
D項、CH3COONH4溶液濃度越大,溶液中銨根離子濃度越大,越有利于Mg(OH)2沉淀的溶解,故D錯誤;
故選C。


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:
【題目】某一化合物的分子式為AB2,A屬ⅥA族元素,B屬ⅦA族元素,A和B在同一周期,它們的電負性值分別為3.44和3.98,已知AB2分子的鍵角為103.3。。下列推斷不正確的是( )
A.AB2分子的空間構型為“V”形
B.A---B鍵為極性共價鍵,AB2分子為非極性分子
C.AB2與H2O相比,AB2的熔點、沸點比H2O的低
D.AB2分子中無氫原子,分子間不能形成氫鍵,而H2O分子間能形成氫鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇、乙醇來源豐富、價格低廉、運輸貯存方便,都是重要的化工原料,有著重要的用途和應用前景,可以用多種方法合成。
I.用CO2生產甲醇、乙醇
(1)已知:H2的燃燒熱為-285.8 kJ/mol,CH3OH(l)的燃燒熱為-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,則CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)將CO2和H2按物質的量之比1:3充入體積為2.0L的恒容密閉容器中反應[生成 H2O(g)],如圖1表示壓強為0.1 MPa和5.0 MPa下CO2轉化率隨溫度的變化關系。

①a、b兩點化學反應速率分別用Va、Vb,表示,則Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a點對應的平衡常數表達式K= ____________________。
(3)在1.0 L恒容密閉容器中投入1 mol CO2和2.75 mol H2發生反應:CO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖2所示,下列說法正確的是_____。
CH3OH (g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖2所示,下列說法正確的是_____。
A.該反應的正反應為放熱反應
B.壓強大小關系為p1<p2<p3
C.M點對應的平衡常數K的值約為1.04×10-2
D.在p2及512 K時,圖中N點υ(正)<υ(逆)
(4)CO2催化加氫合成乙醇的反應為:2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) △H;m代表起始時的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始時的投料比,即m=![]()

①圖3中投料比相同,溫度T3>T2>T1,則該反應的焓變△H____0(填“>”、“<”)。
②m=3時,該反應達到平衡狀態后p(總)=20a MPa,恒壓條件下各物質的物質的量分數與溫度的關系如圖4所示,則曲線b代表的物質為_________(填化學式),T4溫度時,反應達到平衡時物質d的分壓p(d)=___________。
Ⅱ.甲醇的應用
(5)以甲醇為主要原料,電化學合成碳酸二甲酯的工作原理如圖5所示。

離子交換膜a為_____(填“陽膜”、“陰膜”),陽極的電極反應式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等鐵的配合物用途非常廣泛。回答下列問題:
(1)基態Fe原子價層電子的電子排布圖(軌道表達式)為______。
(2)Fe與Ca位于同一周期且最外層電子構型相同,鐵的熔點和沸點均比鈣的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的電負性從大到小的順序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配體為CH3CN和TCNE(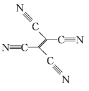 )。
)。
①CH3CN中碳原子的雜化方式是 ____ 和_____ 。
②TCNE中第一電離能較大的是 ___(填元素符號),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 鍵與π鍵的數目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食鹽的抗結劑,強熱分解有Fe3C生成, Fe3C 的晶胞結構如圖所示:
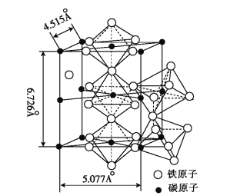
Fe3C的密度為 ___(列出計算式)g·cm-3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】半導體光催化CO2機理如圖甲所示,設計成電化學裝置如圖乙所示,則下列說法正確的是
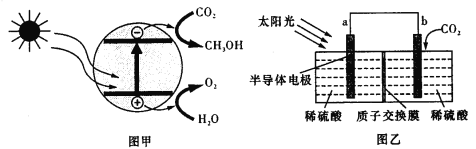
A.若導線上有4mol電子移動,則質子交換膜左側產生22.4LO2
B.裝置中進行的總反應一定是自發的氧化還原反應
C.圖乙中的能量轉化形式為:光能→電能→化學能
D.b極上的電極反應為:CO2+6H+-6e-![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙氣中含有大量氮氧化物NOx,工業脫硝技術成為研究熱點。
(1)汽車尾氣中NO和CO可利用車載催化劑轉化為無毒物質排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
寫出催化轉化的熱化學方程式_________。
(2)臭氧氧化-堿吸收法可有效脫除NO,氧化原理為:NO(g)+O3(g)![]() NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容積為2L的密閉容器中充入含1.0 mol NO的模擬煙氣和2.0 mol O3,在不同溫度,經過相同時間(10min)NO的轉化率如圖所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容積為2L的密閉容器中充入含1.0 mol NO的模擬煙氣和2.0 mol O3,在不同溫度,經過相同時間(10min)NO的轉化率如圖所示。

①100℃時,從開始反應到P點的平均反應速率v(NO)=__________。
②反應時同時發生副反應:2O3![]() 3O2,共有15%的O3自身分解為O2。則P點時O3的物質的量為________mol。
3O2,共有15%的O3自身分解為O2。則P點時O3的物質的量為________mol。
(3)選擇性催化還原技術(NCR)可在較低溫度下脫硝,原理如圖I,天然錳礦可作催化劑。

以NO代表氮氧化物,寫出反應方程式_____________________;實驗測得脫硝率隨溫度的變化如圖II所示,請分析溫度高于250℃時脫硝率下降的原因可能是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期主族元素R、W、X、Y、Z的原子序數依次增大,R、Y同主族。m、n、q是由這些元素組成的三元化合物,0.1 molL-l q溶液常溫下的pH=1;r、s、t、u是由這些元素組成的二元化合物,r常用作調味劑,t通常為液態;v是元素X的一種常見單質。上述物質的轉化關系如圖所示。下列說法正確的是
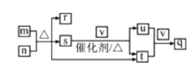
A.原子半徑:R<W<X<Z<YB.n、r、t中化學鍵類型相同
C.u、v、q中均含有X元素D.m、s均屬于堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用電化學原理,將 NO2、O2 和熔融 KNO3 制成燃料電池,模擬工業電解法來處理含 Cr2O72-廢水,如下圖所示;電解過程中溶液發生反應: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2 O。
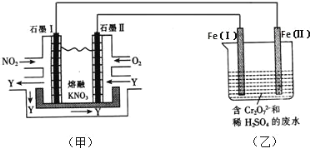
①甲池工作時,NO2 轉變成綠色硝化劑 Y,Y 是 N2O5,可循環使用,則石墨Ⅱ附近發生的電極反應式為______。
②向完全還原為 Cr3+的乙池工業廢水中滴加 NaOH 溶液,可將鉻以 Cr(OH)3 沉淀的形式除去,已知 Cr(OH)3 存在以下溶解平衡:Cr(OH)(s)![]() Cr3+(aq)+3OH-(aq),常溫下 Cr(OH)3 的溶度積 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 應調至___________。
Cr3+(aq)+3OH-(aq),常溫下 Cr(OH)3 的溶度積 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 應調至___________。
(2)鎘鎳可充電電池在現代生活中有廣泛應用,它的充、放電反應按下式進行: Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列問題:
①放電時,金屬 Cd 作______極;
②充電時的陽極電極反應式為。_____
③充電時,當電路中通過 0.2moleˉ,陰極質量將___________(填“增加”、“減少”)___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com