
| 容器編號 | 起始時各物質物質的量/mol | 達到平衡的時間/min | 達平衡時體系能量的變化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出熱量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出熱量:Q | |
分析 (1)正反應為放熱反應,則斷鍵吸收的總能量小于成鍵放出的總能量;
(2)平衡時放出熱量為32.8 kJ,則參加反應的CO為$\frac{32.8kJ}{41kJ/mol}$=0.8mol,進而計算CO轉化率;
(3)容器①、②溫度相同,平衡常數相同,根據容器①中消耗CO物質的量,計算平衡時各物質的物質的量,反應前后氣體體積不變,用物質的量代替濃度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$計算平衡常數;
(4)a.容器①、②中CO、H2O起始物質的量之比均為1:4,反應前后氣體體積不變,恒溫恒容下二者為等效平衡,平衡時同種物質的含量相等;
b.容器①、②為等效平衡,平衡時CO轉化率相等,計算容器②中反應CO的物質的量,結合熱化學方程式計算放出的熱量;
c.濃度越大,反應速率越快;
d.由方程式可知生成的水的物質的量等于消耗CO物質的量,根據v=$\frac{△c}{△t}$計算v(H2O);
(5)已知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
②2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,
根據蓋斯定律,①×2+②可得:2CO(g)+O2(g)﹦2CO2(g);
(6)(6)容器①中反應進行到t min時,測得混合氣體中CO2的物質的量為0.6mol,n(NaOH)=0.2L×5mol/L=1mol,1:2<n(CO2):n(NaOH)=0.6:1=3:5<1:1,故生成Na2CO3、NaHCO3,根據鈉離子守恒、碳原子守恒列方程計算Na2CO3、NaHCO3的物質的量,進而書寫離子方程式.
解答 解:(1)正反應為放熱反應,反應物分子化學鍵斷裂時所吸收的總能量小于生成物分子化學鍵形成時所釋放的總能量,
故答案為:小于;
(2)平衡時放出熱量為32.8 kJ,則參加反應的CO為$\frac{32.8kJ}{41kJ/mol}$=0.8mol,則CO轉化率為$\frac{0.8mol}{1mol}$×100%=80%,
故答案為:80%;
(3)容器①、②溫度相同,平衡常數相同,容器①中消耗CO物質的量為0.8mol,則:
CO(g)+H2O(g)═CO2(g)+H2(g)
起始量(mol):1 4 0 0
變化量(mol):0.8 0.8 0.8 0.8
平衡量(mol):0.2 3.2 0.8 0.8
反應前后氣體體積不變,用物質的量代替濃度計算平衡常數,則K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.8×0.8}{0.2×3.2}$=1,
故答案為:1;
(4)a.容器①、②中CO、H2O起始物質的量之比均為1:4,反應前后氣體體積不變,恒溫恒容下二者為等效平衡,兩容器中H2的體積分數相等,故a正確;
b.容器①、②為等效平衡,平衡時CO轉化率相等,容器②中反應CO的物質的量為2mol×80%=1.6mol,放出的熱量為1.6mol×41kJ/mol=65.6kJ,故b錯誤;
c.容器②中反應物起始濃度比①中的大,故容器②中開始反應速率較快,故c錯誤;
d.由方程式可知生成的水的物質的量等于消耗CO物質的量,則v(H2O)=$\frac{\frac{0.8mol}{VL}}{{t}_{1}min}$=$\frac{0.8}{V{t}_{1}}$mol/(L.min),故d錯誤,
故選:a;
(5)已知:①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJ/mol
②2H2(g)+O2(g)═2H2O (g)△H=-484kJ/mol,
根據蓋斯定律,①×2+②可得:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol,
故答案為:2CO(g)+O2(g)﹦2CO2(g)△H=-566kJ/mol;
(6)容器①中反應進行到t min時,測得混合氣體中CO2的物質的量為0.6mol,n(NaOH)=0.2L×5mol/L=1mol,1:2<n(CO2):n(NaOH)=0.6:1=3:5<1:1,故生成Na2CO3、NaHCO3,設Na2CO3、NaHCO3的物質的量分別為xmol、ymol,則$\left\{\begin{array}{l}{x+y=0.6}\\{2x+y=1}\end{array}\right.$,解得x=0.4,y=0.2,故反應離子方程式為:3CO2+5OH-═2CO32-+HCO3-+2H2O;
故答案為:3CO2+5OH-═2CO32-+HCO3-+2H2O.
點評 本題考查化學平衡計算與影響因素、平衡常數、蓋斯定律應用、離子方程式書寫等,注意理解效平衡規律:1、恒溫恒容,反應前后氣體體積不等,按化學計量數轉化一邊,對應物質滿足等量;反應前后氣體體積相等,按化學計量數轉化一邊,對應物質滿足等比,2:恒溫恒壓,按化學計量數轉化一邊,對應物質滿足等比.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F、G均為短周期元素,原子序數依次遞增.A元素原子核內無中子,B元素原子最外層電子數是次外層電子數的2倍,D是地殼中含量最多的元素,E是短周期中金屬性最強的元素,F與G位置相鄰,G是同周期元素中原子半徑最小的元素.請用化學用語回答:
A、B、C、D、E、F、G均為短周期元素,原子序數依次遞增.A元素原子核內無中子,B元素原子最外層電子數是次外層電子數的2倍,D是地殼中含量最多的元素,E是短周期中金屬性最強的元素,F與G位置相鄰,G是同周期元素中原子半徑最小的元素.請用化學用語回答: .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
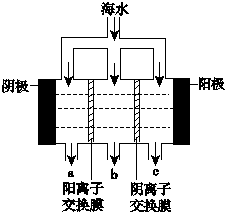 《科學》曾評出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一種重要的自然資源,是人類賴以生存不可缺少的物質.水質優劣直接影響人體健康.海洋是化學資源寶庫,海洋資源的綜合利用具有廣闊的前景.人類把海水淡化,就可以得到大量的飲用水,常規蒸餾法,技術和工藝比較完備,但也存在較大缺陷,大量推廣離子交換法和電滲析法.
《科學》曾評出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一種重要的自然資源,是人類賴以生存不可缺少的物質.水質優劣直接影響人體健康.海洋是化學資源寶庫,海洋資源的綜合利用具有廣闊的前景.人類把海水淡化,就可以得到大量的飲用水,常規蒸餾法,技術和工藝比較完備,但也存在較大缺陷,大量推廣離子交換法和電滲析法.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Na+2NH3=2NaNH2+H2↑ | B. | NH3+HCl=NH4Cl | ||
| C. | 4NH3+6NO=5N2+6H2O. | D. | 3SiH4+4NH3=Si3N4+12H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Na:兩個鈉元素 | |
| B. | 2OH-:兩個氫氧根離子 | |
| C. | $\stackrel{+2}{M}$g:鎂元素的化合價為+2價 | |
| D. | NO2:一個二氧化氮分子含有兩個氧原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| D. | CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量NaHCO3、Na2CO3分別與同濃度鹽酸完全反應,消耗的鹽酸體積Na2CO3是NaHCO3的二倍 | |
| B. | Na2O2和Na2O均可以和鹽酸反應生成相應的鹽,都屬于堿性氧化物 | |
| C. | 將澄清石灰水分別加入NaHCO3和Na2CO3兩種鹽溶液中,只有Na2CO3溶液產生沉淀 | |
| D. | Na2O2和Na2O中Na2O更穩當,Na2O2在一定條件下可以轉化為Na2O |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

| 溫度/℃ | 400 | 500 | 830 |
| 平衡常數K | 10 | 9 | 1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com