
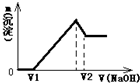
 將0.1mol鎂、鋁合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀與所加NaOH溶液體積的關系如圖所示.試回答下列問題:
將0.1mol鎂、鋁合金溶于100mL2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,生成沉淀與所加NaOH溶液體積的關系如圖所示.試回答下列問題: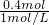 =0.4L=400ml
=0.4L=400ml n(Na+)=
n(Na+)= n(NaOH)=
n(NaOH)= ×0.16L×1mol/L=0.08mol
×0.16L×1mol/L=0.08mol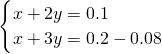 ;解得:
;解得: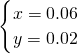
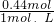 =0.44L=440ml
=0.44L=440ml

 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:
| 28 |
| NA |
| 28 |
| NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
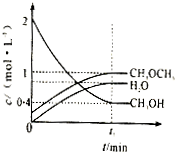 Ⅰ.(1)利用水煤氣合成二甲醚(CH3OCH3)的熱化學方程式為:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.該反應在一定條件下的密閉容器中達到平衡后,為同時提高反應速率和二甲醚的產率,可以采取的措施是
Ⅰ.(1)利用水煤氣合成二甲醚(CH3OCH3)的熱化學方程式為:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),△H=-274KJ/mol.該反應在一定條件下的密閉容器中達到平衡后,為同時提高反應速率和二甲醚的產率,可以采取的措施是查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com