
【題目】已知高錳酸鉀與重鉻酸鉀(K2Cr2O7)都是化學中常用的強氧化劑,高錳酸鉀溶液呈紫紅色而重鉻酸鉀溶液中存在如下平衡:2CrO42-(黃色)+2H+![]() Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
Cr2O72-(橙色)+H2O,若要使溶液的橙色加深,下列可采用的方法是( )
A.加入適量小蘇打B.加入適量稀硝酸
C.加入適量燒堿固體D.加水稀釋
科目:高中化學 來源: 題型:
【題目】根據雜化軌道理論和價電子對互斥理論模型判斷,下列分子或離子的中心原子的雜化方式及空間構型正確的是( )
選項 | 分子或離子 | 中心原子雜化方式 | 價電子對互斥理論模型 | 分子或離子的空間構型 |
A |
|
| 直線形 | 直線形 |
B |
|
| 平面三角形 | 三角錐形 |
C |
|
| 四面體形 | 平面三角形 |
D |
|
| 四面體形 | 正四面體形 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧乙酸(CH3COOOH)是一種高效消毒劑,性質不穩定遇熱易分解,可利用高濃度的雙氧水和冰醋酸反應制得,某實驗小組利用該原理在實驗室中合成少量過氧乙酸。裝置如圖所示。回答下列問題:
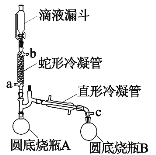
已知:①常壓下過氧化氫和水的沸點分別是158℃和100℃。
②過氧化氫易分解,溫度升高會加速分解。
③雙氧水和冰醋酸反應放出大量的熱。
(1)雙氧水的提濃:蛇形冷凝管連接恒溫水槽,維持冷凝管中的水溫為60℃,c口接抽氣泵,使裝置中的壓強低于常壓,將滴液漏斗中低濃度的雙氧水(質量分數為30%)滴入蛇形冷凝管中。
①蛇形冷凝管的進水口為___________。
②向蛇形冷凝管中通入60℃水的主要目的是________。
③高濃度的過氧化氫最終主要收集在______________(填圓底燒瓶A/圓底燒瓶B)。
(2)過氧乙酸的制備:向100mL的三頸燒瓶中加入25mL冰醋酸,滴加提濃的雙氧水12mL,之后加入濃硫酸1mL,維持反應溫度為40℃,磁力攪拌4h后,室溫靜置12h。
①向冰醋酸中滴加提濃的雙氧水要有冷卻措施,其主要原因是__________。
②磁力攪拌4h的目的是____________。
(3)取V1mL制得的過氧乙酸溶液稀釋為100mL,取出5.0mL,滴加酸性高錳酸鉀溶液至溶液恰好為淺紅色(除殘留H2O2),然后加入足量的KI溶液和幾滴指示劑,最后用0.1000mol/L的Na2S2O3溶液滴定至終點,消耗標準溶液V2mL(已知:過氧乙酸能將KI氧化為I2;2Na2S2O3+I2=Na2S4O6+2NaI)。
①滴定時所選指示劑為_____________,滴定終點時的現象為___________。
②過氧乙酸與碘化鉀溶液反應的離子方程式為_________。
③制得過氧乙酸的濃度為________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了測定某有機物A的結構,做如下實驗:
①將2.3g該有機物完全燃燒,生成0.1molCO2和2.7g水;
②用質譜儀測定其相對分子質量,得到如圖1所示的質譜圖;
③用核磁共振儀處理該化合物,得到如圖2所示圖譜,圖中三個峰的面積之比是1∶2∶3。
試回答下列問題:
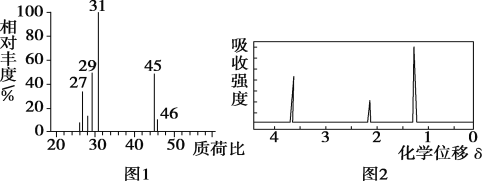
(1)有機物A的相對分子質量是__。
(2)寫出有機物A的結構簡式:__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將 0.10 mol·L-1 鹽酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 隨加入鹽酸體積變化曲線如圖所示。已知:pOH=—lgc(OH),下列正確的是
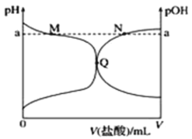
A.M 點所示溶液中可能存在:c(Cl)>c(NH4+)
B.M 點到Q點所示溶液中水的電離程度先變大后減小
C.Q 點鹽酸與氨水恰好中和
D.N 點所示溶液中可能存在:c(NH4+)+c(NH3·H2O)=c(Cl)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)設計的原電池如圖所示。
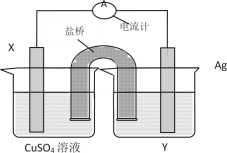
請回答下列問題:
(1)電解質溶液Y是__;
(2)X電極上發生的電極反應為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據原子結構、元素周期表和元素周期律的知識回答下列問題:
(1)A元素次外層電子數是最外層電子數的![]() ,其外圍電子的軌道表示式是 ________ 。
,其外圍電子的軌道表示式是 ________ 。
(2)B是1~36號元素原子核外電子排布中未成對電子數最多的元素,B元素的名稱是 _______ ,在元素周期表中的位置是 _______ 。
(3)C元素基態原子的軌道表示式是下圖中的 ____________ (填序號),另一軌道表示式不能作為基態原子的軌道表示式是因為它不符合 ____________ (填序號)。
①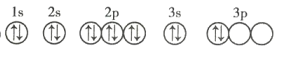
②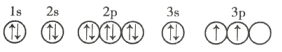
A 能量最低原則 B 泡利不相容原理 C 洪特規則
(4)元素的氣態電中性基態原子失去最外層一個電子轉化為氣態基態正離子所需的最低能a叫作第一電離能(設為E)。第三周期元素的第一電離能示意圖如圖所示:
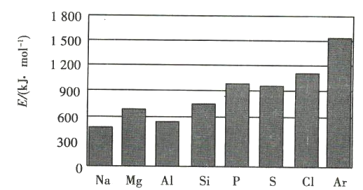
①同周期內,隨著原子序數的增大,E值變化的總趨勢是 ____________ ;
②根據圖中提供的信息,可推斷出E氧 ______ E氟(填“>”“<”或“=”,下同);
③根據第一電離能的含義和元素周期律,可推斷出E鎂 ____________ E鈣。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨氮廢水是生活中常見污染物之一,可用電解法加以去除。實驗室用石墨電極電解一定濃度的(NH4)2SO4與NaCl混合溶液來模擬該過程。
(1)電解處理氨氮廢水電解過程中,溶液初始Cl-濃度和pH對氨氮去除速率與能耗(處理一定量氨氮消耗的電能)的影響關系如圖1和圖2所示:
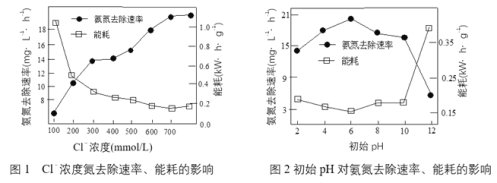
①根據圖中數據,處理廢水合適的條件是_______________。
②實驗中發現陽極會持續產生細小氣泡,氣泡上浮過程中又迅速消失。結合圖1,用電極反應式和離子方程式解釋Cl-去除氨氮的原因_______________。
③圖1中當Cl-濃度較低時、圖2中當初始pH達到12時,均出現氨氮去除速率低而能耗高的現象,共同原因是_______________。
(2)氨的定量測定使用下圖裝置檢測廢水中的氨氮總量是否合格。
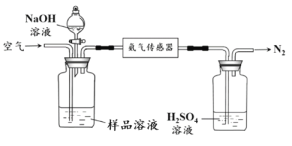
①利用平衡原理分析含氨氮水樣中加入NaOH溶液的作用:_______________。
②若利用氨氣傳感器將1 L水樣中的氨氮完全轉化為N2時,轉移電子的物質的量為6×10-4 mol,則樣品混合液中氨氮(以氨氣計)含量為_______________mg·L-1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com