
為探索工業含鋁、鐵、銅合金廢料的再利用,甲同學設計的實驗方案如下圖。下列說法正確的是

溶液X為稀硫酸,氣體Y為氨氣
由溶液F獲得溶質F固體的過程中,須控制條件防止其氧化和分解
使用足量稀硫酸時,試劑Z選用H2O2或適量HNO3均獲得膽礬晶體
D、操作①為過濾,操作②為蒸發結晶、洗滌、干燥
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2015-2016學年浙江省溫州市十校聯合高二下期中化學試卷(解析版) 題型:選擇題
某同學設計了由乙醇合成乙二醇的路線如下。下列說法正確的是( )
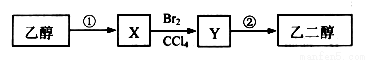
A. X可以發生加成反應
B. 等物質的量的乙醇、X完全燃燒,消耗氧氣的量不相同
C. 步驟②需要在氫氧化鈉醇溶液中反應
D. 步驟①的反應類型是水解反應
查看答案和解析>>
科目:高中化學 來源:2016屆河南省原推薦高三四月高考仿真模擬理綜化學試卷(解析版) 題型:簡答題
【化學——選修3:物質結構與性質】
物質的結構決定物質的性質。請回答下列涉及物質結構和性質的問題:
(1)第二周期中,元素的第一電離能處于B與N之間的元素有_________種。
(2)某元素位于第四周期Ⅷ族,其基態原子的未成對電子數與基態碳原子的未成對電子數相同,則其基態原子的價層電子排布式為_________________。
(3)乙烯酮(CH2=C=O)是一種重要的有機中間體,可用CH3COOH在(C2H5O)3P=O存在下加熱脫H2O得到。乙烯酮分子中碳原子雜化軌道類型是_____________,1mol(C2H5O)3P=O分子中含有的σ鍵的數目為__________________。
(4)已知固態NH3、H2O、HF的氫鍵鍵能和結構如下:
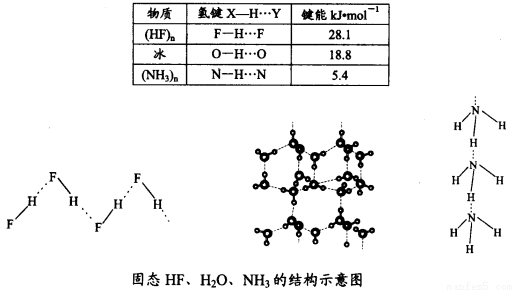
解釋H2O、HF、NH3沸點依次降低的原因___________________。
(5)碳化硅的結構與金剛石類似,其硬度僅次于金剛石,具有較強的耐磨性能。碳化硅晶胞結構中每個碳原子周圍與其距離最近的硅原子有___________個,與碳原子等距離最近的碳原子有__________個。已知碳化硅晶胞邊長為apm,則晶胞圖中1號硅原子和2號碳原子之間的距離為________pm,碳化硅的密度為__________g/cm3。
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省佛山市高三4月二模理綜化學試卷(解析版) 題型:填空題
己二酸是合成尼龍-66的主要原料之一。實驗室合成己二酸的原理、有關數據及裝置示意圖如下:3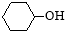 +8HNO3 —→ 3
+8HNO3 —→ 3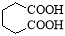 +8NO↑+7H2O
+8NO↑+7H2O

實驗步驟如下:
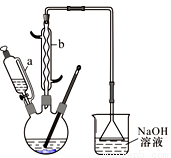
Ⅰ.在三口燒瓶中加入16 mL 50%的硝酸(密度為1.31 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL環己醇。
Ⅱ.水浴加熱三口燒瓶至50℃左右,移去水浴,緩慢滴加5~6滴環己醇,搖動三口燒瓶,觀察到有紅棕色氣體放出時再慢慢滴加剩下的環己醇,維持反應溫度在60 ℃~65 ℃之間。
Ⅲ.當環己醇全部加入后,將混合物用80 ℃~90 ℃水浴加熱約10 min(注意控制溫度),直至無紅棕色氣體生成為止。
Ⅳ.趁熱將反應液倒入燒杯中,放入冰水浴中冷卻,析出晶體后過濾、洗滌、干燥、稱重。
請回答下列問題:
(1)裝置b的名稱為 ,使用時要從 (填“上口”或“下口”)通入冷水;滴液漏斗的細支管a的作用是
(2)本實驗所用50%的硝酸的物質的量濃度為 ;實驗中,氮氧化物廢
氣(主要成分為N02和NO)可以用NaOH溶液來吸收,其主要反應為:
2N02+2NaOH=NaN02+NaN03+H20和NO+N02+2NaOH=2NaN02+H20
其中NaOH溶液可以用Na2C03溶液來替代,請模仿上述反應,寫出Na2C03溶液吸收的兩個方程式:
;
(3)向三口燒瓶中滴加環己醇時,反應溫度迅速上升,為使反應溫度不致過高,必要時可采取的措施是 。
(4)為了除去可能的雜質和減少產品損失,可分別用 和 洗滌晶體。
查看答案和解析>>
科目:高中化學 來源:2016屆廣東省佛山市高三4月二模理綜化學試卷(解析版) 題型:選擇題
傘形酮可由雷瑣苯乙酮和蘋果酸在一定條件下反應制得,下列說法錯誤的是
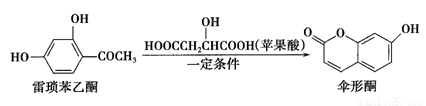
A.雷瑣苯乙酮有兩種含氧官能團
B.1mol傘形酮與足量NaOH溶液反應,最多可消耗2molNaOH
C.傘形酮難溶于水
D.雷瑣苯乙酮和傘形酮都能跟FeCl3溶液發生顯色反應
查看答案和解析>>
科目:高中化學 來源:2016屆浙江省寧波市高考模擬理綜化學試卷(解析版) 題型:選擇題
下列說法正確的是
A、蒸餾實驗開始時應先加熱后通冷凝水
B、不能用濕潤的pH試紙測定溶液的pH,否則必然會使實驗結果產生誤差
C、提取海帶中碘元素時,為保證I-完全氧化為I2,加入的氧化劑(H2O2或新制氯水)應過量
D、在中和熱測定實驗中,為準確測得反應前后的溫差,應將已分別測得溫度的氫氧化鈉溶液與鹽酸在量熱劑中快速混合,并不斷輕輕攪拌,測量混合液的最高溫度
查看答案和解析>>
科目:高中化學 來源:2016屆天津市高三下學期八校聯考化學試卷(解析版) 題型:選擇題
下列說法不正確的是
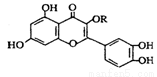
A.0.02 mol•L—1醋酸與0.02 mol•L—1NaOH等體積混合后的溶液中加少量的CH3COONa固體則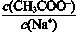 增大
增大
B.常溫下,反應C(s)+CO2(g)=2CO(g)不能自發進行,則該反應的△H>0
C.lmol該化合物與NaOH溶液作用消耗NaOH的物質的量以及與氫氣加成所需的氫氣的物質的量分別是4 mol、8 mol
D.紅外光譜分析不能區分乙醇和乙醚
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧省高一下期中化學試卷(解析版) 題型:選擇題
在一定溫度下的定容密閉容器中,當物質的下列物理量不再變化時,不能說明反應A(s)+2B(g) C(g)+D(g)已達平衡狀態的是
C(g)+D(g)已達平衡狀態的是
A.混合氣體的壓強 B.混合氣體的密度
C.B的物質的量濃度 D.氣體的平均相對分子質量
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下期中化學試卷(解析版) 題型:填空題
已知298 K時,合成氨反應:N2(g)+3H2(g) 2NH3(g),生成2 mol NH3放出92.4 kJ熱量。在該溫度下,取1 mol N2(g)和3 mol H2(g)在體積為2L的密閉容器中充分反應,放出的熱量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
2NH3(g),生成2 mol NH3放出92.4 kJ熱量。在該溫度下,取1 mol N2(g)和3 mol H2(g)在體積為2L的密閉容器中充分反應,放出的熱量 (填“等于”“大于”或“小于”)92.4 kJ;原因是
如果反應5分鐘達到平衡時氣體總物質的量為2.5mol,則這段時間內氫氣的反應速率為 ,達平衡時氮氣的轉化率為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com