

分析 A、B、C、D、E、F均為短周期主族元素,且它們的原子序數依次增大,B和E同主族,D是地殼中含量最多的金屬元素則D為Al,E、R原子序數均大于Al,處于第三周期,而E元素原子的最外層電子數是電子層數的2倍,最外層電子數為6,故E為S元素,F為Cl;B和E同主族,則B為O元素;A、B(氧)在元素周期表中處于相鄰的位置,A的原子序數小于B(氧),故A為N元素;C元素原子在同周期主族元素中原子半徑最大,處于IA族,原子序數介于氧、鋁之間,故C為Na,據此解答.
解答 解:A、B、C、D、E、F均為短周期主族元素,且它們的原子序數依次增大,B和E同主族,D是地殼中含量最多的金屬元素則D為Al,E、R原子序數均大于Al,處于第三周期,而E元素原子的最外層電子數是電子層數的2倍,最外層電子數為6,故E為S元素,F為Cl;B和E同主族,則B為O元素;A、B(氧)在元素周期表中處于相鄰的位置,A的原子序數小于B(氧),故A為N元素;C元素原子在同周期主族元素中原子半徑最大,處于IA族,原子序數介于氧、鋁之間,故C為Na.
(1)F為Cl,原子結構示意圖為 ,故答案為:
,故答案為: ;
;
(2)電子層結構相同的離子,核電荷數越大離子半徑越小,離子電子層越多離子半徑越大,故離子半徑:S2->O2->Na+,故答案為:S2->O2->Na+;
(3)A的氣態氫化物、最高價氧化物對應水化物分別為氨氣、硝酸,二者反應生成硝酸銨,屬于離子化合物,故答案為:離子化合物;
(4)加熱條件下氧氣與鈉的反應生成Na2O2,含有離子鍵、共價鍵,Na2O2溶于水發生反應的化學方程式:2Na2O2+2H2O=4NaOH+O2↑,立即向溶液中滴加酚酞溶液,由于生成氫氧化鈉,溶液呈堿性,溶液顏色變紅,過氧化鈉具有強氧化性,可以漂白有色物質,溶液顏色又褪去,觀察到溶液顏色:先變紅后褪色,
故答案為:離子鍵、共價鍵;2Na2O2+2H2O=4NaOH+O2↑;先變紅后褪色;
(5)Al與氫氧化鈉溶液反應本質為Al與水反應生成氫氧化鋁與氫氣,氫氧化鋁再與氫氧化鈉反應生成偏鋁酸鈉與水,反應中Al為還原劑、水為氧化劑,由2Al+6H2O=2Al(OH)3+3H2↑可知,反應氧化劑與還原劑的物質的量之比為3:1,
故答案為:3:1.
點評 本題考查結構性質位置關系應用,難度中等,推斷元素是解題關鍵,(4)(5)為易錯點,(4)中學生容易忽略過氧化鈉的漂白性,(5)需要學生明白反應原理.


科目:高中化學 來源: 題型:解答題
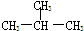
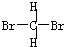 和
和 E.甲烷和庚烷F.
E.甲烷和庚烷F.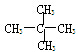 和C(CH)3
和C(CH)3 查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和苯都能發生加成反應 | |
| B. | 乙醇和乙酸都能與氫氧化鈉溶液反應 | |
| C. | 乙烯和苯都能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖和蔗糖都可發生銀鏡反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
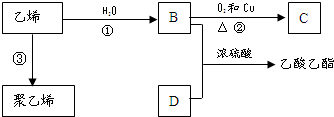 已知乙烯能發生如圖轉化
已知乙烯能發生如圖轉化 ,反應類型加聚反應.
,反應類型加聚反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
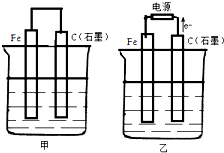 如圖甲、乙是電化學實驗裝置.
如圖甲、乙是電化學實驗裝置.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
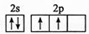 .第四周期與其有相同未成對電子數的過渡金屬有Ti、Ni(填元素符號)
.第四周期與其有相同未成對電子數的過渡金屬有Ti、Ni(填元素符號)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
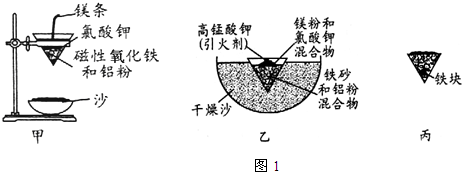
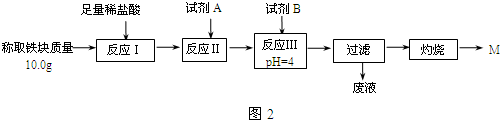
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 開始沉淀時的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全時的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
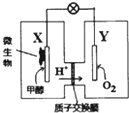 某酸性介質的甲醇微生物電池,是一種利用微生物將化學能直接轉化成電能的裝置.下列敘述正確的是( )
某酸性介質的甲醇微生物電池,是一種利用微生物將化學能直接轉化成電能的裝置.下列敘述正確的是( )| A. | 電子從Y電極流向X電極 | |
| B. | 02在Y電極上發生氧化反應 | |
| C. | X電極的電極反應為:CH3OH+H2O-6e-═CO2↑+6H+ | |
| D. | 若1mol電子在導線中通過,則有2mol的H+通過質子交換膜 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com