
【題目】常溫下,pH均為2、體積均為V0的HA、HB、HC溶液,分別加水稀釋至體積為V,溶液pH隨lg![]() 的變化關系如圖所示,下列敘述錯誤的是( )
的變化關系如圖所示,下列敘述錯誤的是( )
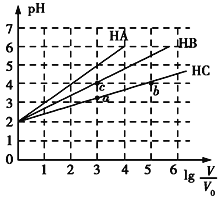
A. 常溫下:Ka(HB)>Ka(HC)
B. HC的電離度:a點<b點
C. 當lg![]() =4時,三種溶液同時升高溫度,
=4時,三種溶液同時升高溫度,![]() 減小
減小
D. 當lg![]() =5時,HA溶液的pH為7
=5時,HA溶液的pH為7
【答案】D
【解析】
根據圖知,pH=2的HA、HB、HC溶液分別稀釋100倍,HA的pH變成4,說明HA是強酸,HB、HC的pH增大小于2,則HB、HC為弱酸,且HB的pH增大幅度大于HC,說明HB的酸性>HC,因此酸性HA>HB>HC,據此分析解答。
A.酸性HB>HC,則Ka(HB)>Ka(HC),故A正確;
B.溶液的濃度越小,弱酸的電離程度越大,因此HC的電離度:a點<b點,故B正確;
C.當lg![]() =4,即稀釋10000倍時,三種溶液同時升高溫度,常見弱電解質的電離程度增大,而HA為強酸,電離程度不變,因此
=4,即稀釋10000倍時,三種溶液同時升高溫度,常見弱電解質的電離程度增大,而HA為強酸,電離程度不變,因此![]() 減小,故C正確;
減小,故C正確;
D.當lg![]() =5時,HA電離出的c(H+)=10-7 mol/L,此時,不能忽略水的電離,溶液中c(H+)略大于10-7 mol/L,pH略小于7,仍顯酸性,故D錯誤;
=5時,HA電離出的c(H+)=10-7 mol/L,此時,不能忽略水的電離,溶液中c(H+)略大于10-7 mol/L,pH略小于7,仍顯酸性,故D錯誤;
故選D。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、W四種化合物均由短周期元素組成。其中X含有四種元素,X、Y、Z的焰色反應均為黃色,W為無色無味氣體。這四種化合物具有如下圖轉化關系(部分反應物、產物及反應條件已略去)。請回答:
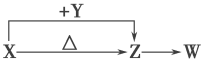
(1)Y的電子式是____________________。
(2)X與Y在溶液中反應的離子方程式是__________________________________________。
(3)X含有的四種元素之間(二種、三種或四種)可組成多種化合物,選用其中某些化合物,利用下圖裝置(夾持固定裝置已略去)進行實驗,裝置Ⅲ中產生白色沉淀,裝置Ⅴ中可收集到一種無色氣體。
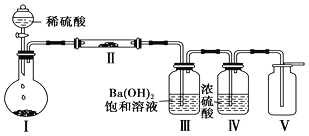
①裝置Ⅰ中反應的化學方程式是_________________________________________________,裝置Ⅱ中反應的化學方程式是________________________________________________。
②用X含有的四種元素中的兩種組成的某化合物,在催化劑存在下制備并收集純凈干燥的裝置Ⅴ中氣體,該化合物的化學式是___________,所需儀器裝置是_______________。 (從上圖選擇必要裝置,填寫編號)。
(4)向Z溶液中通入氯氣,可制得某種生產和生活中常用的漂白、消毒的物質,同時有X生成,該反應的化學方程式是__________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式的書寫及評價均合理的是( )
選項 | 離子方程式 | 評價 |
A | 將2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正確;Cl2過量,可將Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液與足量的NaOH溶液反應: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正確;酸式鹽與堿反應生成正鹽和水 |
C | 過量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正確;說明酸性:H2SO3強于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等體積混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正確;第一步反應和第二步反應消耗的H+的物質的量之比為2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗研究小組欲檢驗草酸晶體分解的產物并測定草酸溶液的濃度(雜質不發生反應)。查閱資料:草酸晶體(H2C2O4·2H2O)在100 ℃開始失水,101.5 ℃熔化,150 ℃左右分解產生H2O、CO和CO2。下面是可供選擇的實驗儀器(圖中某些加熱、夾持裝置已略去),實驗所需藥品不限。
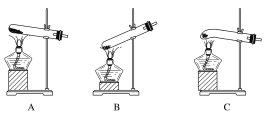
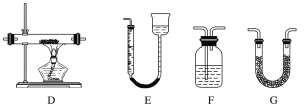
(1)最適宜加熱分解草酸晶體的裝置是C。若選裝置A可能會造成的后果是______________;若選裝置B可能會造成的后果是_________________________________。
(2)實驗利用裝置“G(堿石灰)—F—D(CuO固體)—F”檢驗CO,則F中盛裝的試劑是_______,證明含有CO的現象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4標準溶液來滴定未知濃度的草酸溶液。
①滴定過程中發生反成的離子方程式為_________________________________________。②滴定過程中操作滴定管的圖示正確的是_________。
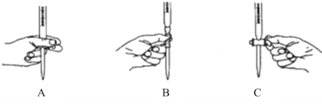
③判斷反應達到滴定終點時的現象為__________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)含11.2 g KOH的稀溶液與1 L0.1mol/L的H2SO4溶液反應放出11.46 kJ的熱量,該反應表示中和熱的熱化學方程式為___________________。
(2)將0.40 mol N2O4氣體充入2 L的恒容密閉容器中發生如下反應:N2O4(g) ![]() 2NO2(g)ΔH。在T1℃和T2℃時,測得NO2的物質的量隨時間變化如圖所示:
2NO2(g)ΔH。在T1℃和T2℃時,測得NO2的物質的量隨時間變化如圖所示:

①T1℃,40~80 s內用N2O4表示該反應的平均反應速率為________mol/(L·s)。
②ΔH________0(填“>”、“<”或“=”)。
(3)向甲、乙兩個容積均為1 L的恒容容器中,分別充入2 mol A、2 mol B和1 mol A、1 mol B。相同條件下(溫度T ℃),發生下列反應:A(g)+B(g)![]() xC(g) ΔH<0。測得兩容器中c(A)隨時間t的變化如圖所示:
xC(g) ΔH<0。測得兩容器中c(A)隨時間t的變化如圖所示:

①甲容器平衡后物質B的轉化率為_______;
②T℃ 時該反應的平衡常數為________。
(4)在25 ℃下,將a mol/L的氨水與0.01mol/L的鹽酸等體積混合,反應平衡時溶液中c(NH4+)=c(Cl-)。
①則溶液顯________性(填“酸”“堿”或“中”);
②用含a的代數式表示NH3·H2O的電離常數Kb=__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用可溶性鋇鹽檢驗硫酸根離子的存在時,先在待測溶液中加入鹽酸,其作用是
A. 形成較多的白色沉淀
B. 形成的沉淀純度更高
C. 排除硫酸根離子以外其他陰離子及銀離子的干擾
D. 排除鋇離子以外的其他陽離子的干擾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于有機物的下列說法正確的是![]()
![]()
A. 在酸性條件下,![]() 的水解產物是
的水解產物是![]() 和
和![]()
B. 油脂在堿性條件下的水解反應稱為皂化反應,反應生成甘油和高級脂肪酸
C. 淀粉與纖維素通式相同,但二者不互為同分異構體
D. 鑒定蔗糖水解產物中的葡萄糖:在水解液中直接加入銀氨溶液并水浴加熱
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com