
【題目】如圖所示3套實驗裝置,分別回答下列問題。

(1)裝置1為鐵的吸氧腐蝕實驗。向插入碳棒的玻璃筒內滴入酚酞溶液,可觀察到碳棒附近的溶液變紅,該電極反應式為___________________。
(2)裝置2中左池為氯化鐵溶液,右池為硫酸銅溶液,一段時間后右池溶液中c(Cu2+)_________(填“增大”、“減小”或“不變”),若該裝置的鹽橋中盛裝的是NH4NO3的瓊脂溶液,則鹽橋中的_____離子(填“NH4+”或“NO3-”)向氯化鐵溶液遷移。
(3)裝置3中甲燒杯盛放100mL 0.2mol/L的NaCl溶液,乙燒杯盛放100mL 0.5mol/L的CuSO4溶液。反應一段時間后,觀察到乙燒杯的石墨電極上有氣泡生成。
①電源的M端為___極;甲燒杯中鐵電極的電極反應式為_______________。
②乙燒杯中電解反應的離子方程式為__________________________________。
③停止電解,取出Cu電極,洗滌、干燥、稱量,電極增重0.32g,甲燒杯中產生的氣體標準狀況下體積為________mL;電解后乙燒杯溶液的pH為______(假設電解前后溶液的體積不變)。
④若要將乙池設計成電解精煉銅的裝置,則乙池的石墨應改成_____(填“粗銅”或“精銅”)。
【答案】O2+4e-+2H2O═4OH- 增大 NH4+ 正 Fe-2e-═Fe2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 112 1 粗銅
2Cu+O2↑+4H+ 112 1 粗銅
【解析】
(1)電解質溶液中滴有酚酞,反應一段時間后,碳棒附近溶液變紅,說明碳棒附近產生OH-,即碳棒電極反應式為O2+2H2O+4e-=4OH-;
(2)電池總反應是Cu+2Fe3+=2Fe2++Cu2+,即Cu電極為負極,反應式為Cu-2e-=Cu2+,右池中c(Cu2+)增大;石墨為正極,根據原電池的工作原理,NH4+向FeCl3溶液遷移;
(3)①乙燒杯石墨電極上有氣泡產生,電極反應式為4OH--4e-=O2↑+2H2O,即石墨為陽極,Cu為陰極,根據電解原理,N為電源的負極,M為電源的正極;Fe電極與M相連,即Fe電極為陽極,根據電解池放電順序,Fe失電子,電極反應式為Fe-2e-=Fe2+;
②乙燒杯電解是CuSO4水溶液,總電極反應式為2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③Cu電極增重0.32g,增重的是析出Cu的質量,即整個電路轉移電子物質的量為0.32×2/64mol=0.01mol,甲池中石墨電極反應式為2H++2e-=H2↑,標準狀況下,產生氫氣的體積為0.01×22.4/2L=0.112L,即112mL;根據②,產生n(H+)=2×0.32/64mol=0.01mol,即c(H+)=0.01/(100×10-3)mol·L-1=0.1mol·L-1,pH=1;
④精煉銅時,粗銅為陽極,陰極為純銅,故乙池的石墨應改為粗銅。


科目:高中化學 來源: 題型:
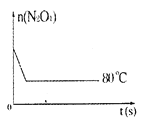
【題目】在80℃時,0.40mol的N2O4氣體充入2L已經抽空的固定容積的密閉容器中發生如下反應:N2O4![]() 2NO2-Q,隔一段時間對該容器內的物質進行分析,得到如下數據:
2NO2-Q,隔一段時間對該容器內的物質進行分析,得到如下數據:
時間(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)計算20s—40s內用N2O4表示的平均反應速率為____。
(2)該反應的平衡常數K=___。
(3)反應進行至100s后將反應混合物的溫度降低,混合氣體的顏色___(填“變淺”、“變深”或“不變”)。
(4)要增大該反應的K值,可采取的措施有(填序號)___,若要重新達到平衡時,使[NO2]/[N2O4]值變小,可采取的措施有(填序號)___。
A.增大N2O4的起始濃度 B.向混合氣體中通入NO2
C.使用高效催化劑 D.升高溫度
(5)如圖是80℃時容器中N2O4物質的量的變化曲線,請在該圖中補畫出該反應在60℃時N2O4物質的量的變化曲線。____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】傳統接觸法制取硫酸能耗大,污染嚴將燃料電池引人硫酸生產工藝可有效解決能耗和環境污染問題,同時提供電能。以燃料電池為電源電解硫酸銅溶液的工作原理示意圖如下所示。
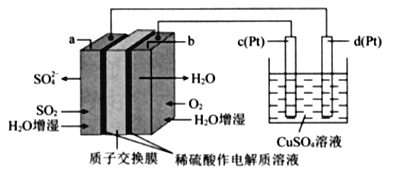
下列說法不正確的是( )
A. b極為正極,電極反應式為O2+4H++4e-=2H20
B. H+由a極通過質子交換膜向b極移動
C. 該燃料電池的總反應式為2SO2+O2+2H2O=2H2SO4
D. 若a極消耗2.24 L(標準狀況)SO2,理論上c極,有6.4g銅析出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸銨[(NH4)2SO4]一種優良的氮肥(俗稱肥田粉),適用于一般土壤和作物,能使枝葉生長旺盛,提高果實品質和產量,增強作物對災害的抵抗能力,可作基肥、追肥和種肥,與氫氧化鈣在加熱的條件下可以生成氨氣。根據所學知識回答下列問題:
(1)基態S原子的價電子排布式為____________,能量最高的電子所處的能層的符號為_________。
(2)SO42-空間構型為__________,中心原子的軌道雜化方式是________,寫出一個與SO42-互為等電子體的分子的化學式__________。
(3)氨氣的沸點(-33.5℃)高于硫化氫的沸點(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一電離能從大到小的順序是___________________。
(5)硫酸銅溶液中通入過量的氨氣會生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ鍵的個數為________。
(6)以四氯化鈦、碳化鈣、疊氮酸鹽作原料,可以生成碳氮化鈦化合物。其結構如下圖所示,這種碳氮化鈦化合物的化學式為________。若將該晶體的晶胞重新切割,使碳原子位于新晶胞的上下面心,則氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源、環境與生產生活和社會發展密切相關。
(1)工業上利用CO和H2在催化劑作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反應中有關物質的化學鍵鍵能數據如下表所示:
CH3OH(g) ,已知反應中有關物質的化學鍵鍵能數據如下表所示:
化學鍵 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
則 CO(g)+2H2(g) ![]() CH3OH(g) △H=__________kJmol-1
CH3OH(g) △H=__________kJmol-1
(2)以甲醇為燃料的新型電池,其成本大大低于以氫氣為燃料的傳統燃料電池。如圖是目前研究較多的一類固體氧化物燃料電池工作原理示意圖。

B極為電池______極,B極的電極反應式為_________________________________。
(3)參考合成反應CO(g)+2H2(g) ![]() CH3OH(g)的平衡常數,回答下列問題:
CH3OH(g)的平衡常數,回答下列問題:
溫度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常數 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①該反應正反應是 ___________(填“放熱”或“吸熱”)反應;
②在T℃時,1L密閉容器中,投入0.1molCO和0.2molH2,達到平衡時,CO轉化率為50%,則T=__________℃。
(4)CH3OH也可由CO2和H2合成。在體積為1L的密閉容器中,充入lmolCO2和3molH2,一定條件下反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,測得CO2和CH3OH(g)濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,測得CO2和CH3OH(g)濃度隨時間變化如圖所示。
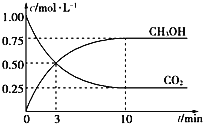
①該反應的平衡常數表達式為K=_______;從反應開始到10min,v(H2)=_____mol/(L·min);
②下列情況能說明該反應一定達到平衡狀態的是___________(填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.氣體的密度不再隨時間改變
C.CO2和CH3OH的濃度之比不再隨時間改變
D.氣體的平均相對分子質量不再隨時間改變
③為了加快化學反應速率且使體系中氣體的物質的量增大,只改變下列某一條件,可采取的措施有__ (填字母)
A.升高溫度 B.縮小容器體積
C.再充入CO2氣體 D.使用合適的催化劑
④相同溫度下,在另一個容積為1 L的密閉容器中充入2mol CH3OH(g)和2molH2O(g),達到平衡時CO2的濃度_______(填“>”、“ <”或“=”)0.25mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于熱化學反應的描述中正確的是
A. HCl和NaOH反應的中和熱△H=-57.3 kJ·mol1,則H2SO4和Ca(OH)2反應的中和熱△H=2×(-57.3)kJ·mol1
B. 甲烷的標準燃燒熱ΔH=-890.3 kJ·mol1,則CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;將1.5 mol H2和過量的N2在此條件下充分反應,放出熱量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;將1.5 mol H2和過量的N2在此條件下充分反應,放出熱量46.2 kJ
D. CO(g)的燃燒熱是283.0kJ·mol1,則2CO2(g) ===2CO(g)+O2(g)反應的△H=+566.0 kJ·mol1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用純凈的CaCO3與l00mL稀鹽酸反應制取CO2,實驗過程記錄如圖所示(CO2的體積己折算為標準狀況下的體積)。下列分析正確的是

A. EF段,用鹽酸表示該反應的平均反應速率為0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,該反應用二氧化碳表示的平均反應速率之比為2:6:7
D. F點收集到的CO2的量最多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于乙醇和乙酸的說法中,正確的是
A.乙醇和乙酸分子中都含有C=O鍵B.乙醇和乙酸互為同分異構體
C.乙醇和乙酸均能使紫色石蕊試液變紅D.乙醇和乙酸相互之間能溶解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等物質的量的Na2CO3·mH2O和BaCl2·nH2O的混合物3.68g,加入足量水攪拌,經充分反應后可得1.97g沉淀。則m和n值分別是
A.10和2B.7和3C.3和1D.1和2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com