
近年來,以天然氣等為原料合成甲醇的難題被一一攻克,極大地促進了甲醇化學的發展。
(1)與炭和水蒸氣的反應相似,以天然氣為原料也可以制得CO和H2,該反應的化學方程式為_________。
(2)合成甲醇的一種方法是以CO和H2為原料,其能量變化如圖所示:
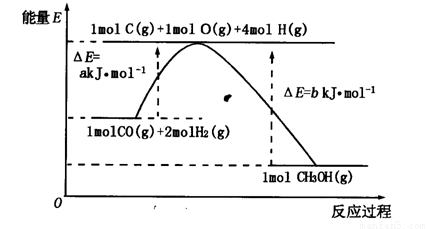
由圖可知,合成甲醇的熱化學方程式為________________________________________。
(3)以CO2為原料也可以合成甲醇,其反應原理為:CO2(g)+3H2(g)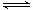 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在lL的密閉容器中,充入1molCO2和3molH2,在500℃下發生反應,測得CO2(g)和CH3OH(g)的濃度隨時問變化如圖所示:
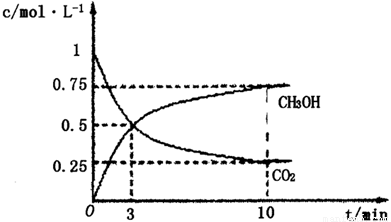
則下列說法正確的是_________________(填字母);
A.3min時反應達到平衡
B.0~10min時用H2表示的反應速率為0.225mol·-1·min-1
C.CO2的平衡轉化率為25%
D.該溫度時化學平衡常數為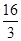 (mol/L)-2
(mol/L)-2
②在相同溫度、相同容積的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下:
|
容器 |
容器1 |
容器2 |
容器3 |
|
反應物投入量(始態) |
1molCO2、3molH2 |
0.5molCO2、1.5molH2 |
1molCH3OH、1molH2O |
|
CH3OH的平衡濃度/mol•L-1 |
c1 |
c2 |
c3 |
|
平衡時體系壓強/Pa |
p1 |
p2 |
p3 |
則下列各量的大小關系為c1___________c3,p2_________p3(填“大于”、“等于”或“小于”)。
(4)近年來,甲醇燃料電池技術獲得了新的突破,如圖所示為甲醇燃料電池的裝置示意圖。電池工作時,分別從b、c充入CH3OH、O2,回答下列問題:
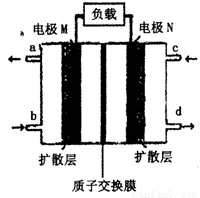
①從d處排出的物質是___________,溶液中的質子移向電極__________(填“M”或“N”);
②電極M上發生的電極反應式為__________________________。
(16分、每空2分)(1)CH4+H2O CO+3H2
CO+3H2
(2)CO(g)+2H2(g)=CH3OH(g) △H=(a-b)kJ/mol (3)①BD ②等于;小于
(4)①H2O N ②CH3OH+H2O-6e-=CO2↑+6H+
【解析】
試題分析:(1)反應物是甲烷和水,生成物是一氧化碳和氫氣,根據原子生活借助于觀察法配平,反應條件是高溫和催化劑,所以該反應的化學方程式是CH4+H2O CO+3H2。
CO+3H2。
(2)根據根據圖像可知,反應物的總能量高于生成物的總能量,因此反應是放熱反應,其反應熱△H=(a-b)kJ/mol,所以其熱化學反應方程式為CO(g)+2H2(g)=CH3OH(g) △H=(a-b)kJ/mol。
(3)①A、根據圖像可知,3min后各物質的濃度還發生變化,所以3min時該反應未達到平衡,故A錯誤; B、根據圖像可知,在0~10min內甲醇的濃度增加了0.75mol/L,所以根據反應的化學方程式可知,消耗氫氣的濃度是0.75mol/L×3=2.25mol/L,因此0~10min時用H2表示的反應速率=2.25mol/L÷10min=0.225mol/(L·min),故B正確;C、根據圖像可知CO2的平衡轉化率=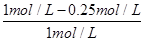 ×100%=75%,故C錯誤; D、根據圖像和以上分析可知,平衡時c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,c(H2)=3c(CO2)=0.75mol/L,所以該溫度下反應的化學平衡常數K=
×100%=75%,故C錯誤; D、根據圖像和以上分析可知,平衡時c(CO2)=0.25mol/L,c(CH3OH)=c(H2O)=0.75mol/L,c(H2)=3c(CO2)=0.75mol/L,所以該溫度下反應的化學平衡常數K=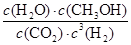 =
=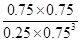 =
=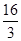 (mol/L)-2,D正確,答案選BD。
(mol/L)-2,D正確,答案選BD。
②根據方程式并采用一邊倒的方法可知,1molCH3OH、1molH2O完全轉化為反應物就是1molCO2、3molH2,因此容器1和容器3是等效平衡,所以平衡時甲醇的濃度c1等于c3;容器2相當于在容器1的基礎上減小壓強,平衡向逆反應方向移動,則平衡時p2 小于p3。
(4)①原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應。因此該燃料電池中,負極通入甲醇,正極通入氧氣。c電極上充入氧氣,即電極N是正極,氧氣得電子和氫離子反應生成水,所以d出來的是水,原電池放電時,氫離子向正極N極移動。
②電極M是負極,通入的是甲醇,失去電子發生氧化反應,因此發生的電極反應式為CH3OH+H2O-6e-=CO2↑+6H+。
考點:考查反應方程式、熱化學反應方程式、電極反應式的書寫;等效平衡的判斷和應用;反應速率和平衡常數的計算以及電化學原理的應用等


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
| 16 |
| 3 |
| 容器 | 容器1 | 容器2 | 容器3 |
| 反應物投入量(始態) | 1molCO2、3molH2 | 0.5molCO2、1.5molH2 | 1molCH3OH、1molH2O |
| CH3OH的平衡濃度/mol?L-1 | c1 | c2 | c3 |
| 平衡時體系壓強/Pa | p1 | p2 | p3 |
查看答案和解析>>
科目:高中化學 來源: 題型:022
近年來,北京、成都等市率先在公交車和出租車中推行用天然氣代替汽油作燃料的改革,取得了顯著進展.走上街頭你會發現不少公交車和出租車上印有“CNG”的標志,代表它們是以天然氣作為燃料的汽車.試問:(1)成都市政府推廣這一改革的主要目的是________(填字母).
(2)天然氣是___________在隔絕空氣的條件下,經微生物發酵作用而生成的,因此,天然氣中貯藏的化學能最終來自于____________.
(3)天然氣的主要成分是_________,該主要成分若出現于煤礦的坑道內,并達到一定濃度時遇____________,便會立即出現瓦斯爆炸.
(4)天然氣的主要成分是一種很好的燃料.已知4 g該主要成分完全燃燒生成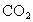 氣體和液態
氣體和液態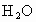 ,放出222.5kJ的熱量,則上述成分燃燒的熱化學方程式為__________.
,放出222.5kJ的熱量,則上述成分燃燒的熱化學方程式為__________.
查看答案和解析>>
科目:高中化學 來源:物理教研室 題型:058
近年來,北京、成都等市率先在公交車和出租車中推行用天然氣代替汽油作燃料的改革,取得了顯著進展.走上街頭你會發現不少公交車和出租車上印有“CNG”的標志,代表它們是以天然氣作為燃料的汽車.試問:(1)成都市政府推廣這一改革的主要目的是________(填字母).
(2)天然氣是___________在隔絕空氣的條件下,經微生物發酵作用而生成的,因此,天然氣中貯藏的化學能最終來自于____________.
(3)天然氣的主要成分是_________,該主要成分若出現于煤礦的坑道內,并達到一定濃度時遇____________,便會立即出現瓦斯爆炸.
(4)天然氣的主要成分是一種很好的燃料.已知4 g該主要成分完全燃燒生成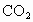 氣體和液態
氣體和液態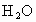 ,放出222.5kJ的熱量,則上述成分燃燒的熱化學方程式為__________.
,放出222.5kJ的熱量,則上述成分燃燒的熱化學方程式為__________.
查看答案和解析>>
科目:高中化學 來源:2013年山東省泰安市高考化學二模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com