
| A. | △H1>0 | B. | △H4=△H1-△H2-2△H3 | ||
| C. | △H4=△H2-△H1-2△H3 | D. | △H4-△H1-△H2<0 |
分析 CaO與水的反應、CaO與鹽酸的反應以及氨氣和氯化氫的反應都是放熱的,焓變小于零,Ca(OH)2與NH4Cl的反應為吸熱反應,△H4>0,根據該蓋斯定律計算反應焓變之間的關系即可.
解答 解:A、CaO與水的反應是放熱的,焓變小于零,△H1<0,故A錯誤;
B、利用蓋斯定律計算,反應④為②-①-③×2,反應熱隨之相加減,可得反應熱△H4=△H2-△H1-2△H3,故B錯誤;
C、利用蓋斯定律計算,反應④為②-①-③×2,反應熱隨之相加減,可得反應熱△H4=△H2-△H1-2△H3,故C正確;
D、CaO與水的反應、CaO與鹽酸的反應都是放熱的,焓變小于零,即△H1<0,△H2<0,Ca(OH)2與NH4Cl的反應為吸熱反應,△H4>0,所以△H4-△H1-△H2>0,故D錯誤.
故選C.
點評 本題涉及蓋斯定律的應用以及反應熱的判斷,屬于基本知識的考查,難度不大.


科目:高中化學 來源: 題型:解答題
| 化學反應 | 平衡常數 | 溫度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

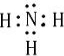 .
. ,其單質在常溫下為黃綠色的氣體,實驗中可以用NaOH溶液吸收,反應的離子方程式為Cl2+2OH-=Cl-+ClO-+H2O.
,其單質在常溫下為黃綠色的氣體,實驗中可以用NaOH溶液吸收,反應的離子方程式為Cl2+2OH-=Cl-+ClO-+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁罐可久盛食醋 | |
| B. | 氫氧化鋁可作胃酸的中和劑 | |
| C. | 鐵表而鍍鋅可以增強其抗腐蝕性 | |
| D. | 含重金屬離子的電鍍廢液不能隨意排放 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
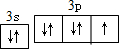
 ,此元素在周期表中的位置是( )
,此元素在周期表中的位置是( )| A. | 第二周期零族 | B. | 第三周期ⅡA族 | C. | 第二周期ⅥA族 | D. | 第三周期IIIA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用鋁槽密閉盛裝濃硫酸 | |
| B. | 工業上利用蛋白質的水解反應生產肥皂和甘油 | |
| C. | 乙醇可用作汽車燃料 | |
| D. | 食醋可用于消除暖水瓶中的水垢 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com