
【題目】鹵素單質在堿性溶液中容易發生歧化反應,歧化的產物依反應溫度的不同而不同。
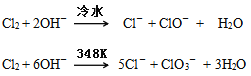
下圖為制取氯氣、氯酸鉀、次氯酸鈉和檢驗氯氣性質的微型實驗裝置:

裝置中盛裝的藥品如下:①多用滴管中裝有5mL濃鹽酸;②微型支管試管中裝有1.5gKMnO4;③微型支管試管中裝有2~3mL濃硫酸;④U形反應管中裝有30%KOH溶液;⑤U形反應管中裝有2mol/LNaOH溶液;⑥、⑦雙U形反應管中分別裝有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾氣出口用浸有0.5mol/LNa2S2O3溶液的棉花輕輕覆蓋住

(1)整套裝置氣密性檢查的方法_________________________。
(2)為了使裝置④、⑤中的反應順利完成,應該控制的反應條件分別為________________________________。
(3)裝置⑥、⑦中能夠觀察到的實驗現象分別是____________________。
(4)如果把裝置⑥、⑦中的試劑互換位置,還能否證明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸鉀和氯化鉀的溶解度曲線如下圖所示,反應結束后,從裝置④中提取氯酸鉀晶體的實驗操作是_____________。
(6)尾氣處理時發生反應的離子方程式為____________________。
(7)選擇微型實驗裝置的優點有___________________(至少寫兩點)。
【答案】 連接好實驗裝置,由⑧導管向⑦裝置中加水,若能形成一段穩定的水柱,則裝置的氣密性良好(其他合理答案也可得分) 裝置④放入348K(或75℃)熱水浴中;裝置⑤放入冰水浴中 裝置⑥中溶液變藍;裝置⑦中溶液變成橙色 能 若互換裝置⑥、⑦中的試劑,Cl2與KBr反應生成Br2,揮發出來與KI反應,也可以證明Cl2的氧化性強于I2 冷卻結晶、過濾 S2O32- + 4Cl2 + 5H2O = 2SO42- + 8Cl- + 10H+ 簡化實驗裝置、節約成本;試劑用量少、能源消耗少;節省空間,縮短實驗時間;減少污染等
【解析】試題分析:本題考查Cl2的實驗室制備,Cl2的性質實驗,KClO3、NaClO的制備。
(1)整套裝置氣密性的檢查用液差法,方法是:連接好實驗裝置,由⑧導管向⑦裝置中加水,若能形成一段穩定的水柱,則裝置的氣密性良好。
(2)根據實驗目的,裝置④中盛放30%KOH溶液,裝置④中發生的反應為3Cl2+6KOH![]() KClO3+5KCl+3H2O,裝置④用于制備KClO3;裝置⑤中盛放2mol/LNaOH溶液,裝置⑤中發生的反應為Cl2+2NaOH=NaCl+NaClO+H2O,裝置⑤用于制備NaClO;根據題給信息,使裝置④中反應順利完成,裝置④放入348K熱水浴中;使裝置⑤中反應順利完成,裝置⑤放入冰水浴中。
KClO3+5KCl+3H2O,裝置④用于制備KClO3;裝置⑤中盛放2mol/LNaOH溶液,裝置⑤中發生的反應為Cl2+2NaOH=NaCl+NaClO+H2O,裝置⑤用于制備NaClO;根據題給信息,使裝置④中反應順利完成,裝置④放入348K熱水浴中;使裝置⑤中反應順利完成,裝置⑤放入冰水浴中。
(3)裝置⑥中盛放KI-淀粉溶液,通入Cl2發生反應:Cl2+2KI=2KCl+I2,I2遇淀粉呈藍色,裝置⑥的實驗現象是:溶液變藍。裝置⑦中盛放KBr溶液,通入Cl2發生反應:Cl2+2KBr=2KCl+Br2,裝置⑦的實驗現象是:溶液變成橙色。
(4)如果把裝置⑥、⑦中的試劑互換位置,裝置⑥中盛放KBr溶液,裝置⑥中發生反應:Cl2+2KBr=2KCl+Br2,由此得出氧化性:Cl2![]() Br2;裝置⑦中盛放KI-淀粉溶液,無論Cl2還是裝置⑥中揮發出來的Br2(g)都能與KI反應生成I2,能說明Cl2或Br2(g)的氧化性強于I2,結合裝置⑥中結論也能證明Cl2的氧化性強于I2;裝置⑥、⑦中試劑互換位置,仍能證明氧化性:Cl2
Br2;裝置⑦中盛放KI-淀粉溶液,無論Cl2還是裝置⑥中揮發出來的Br2(g)都能與KI反應生成I2,能說明Cl2或Br2(g)的氧化性強于I2,結合裝置⑥中結論也能證明Cl2的氧化性強于I2;裝置⑥、⑦中試劑互換位置,仍能證明氧化性:Cl2![]() I2。
I2。
(5)根據溶解度曲線,KClO3的溶解度隨溫度升高明顯增大,KCl在低溫時溶解度大于KClO3,高溫時溶解度小于KClO3,從裝置④中提取KClO3晶體的實驗操作:將溶液冷卻結晶、過濾,洗滌,干燥。
(6)尾氣用0.5mol/LNa2S2O3溶液吸收,Cl2將S2O32-氧化成SO42-,Cl2被還原成Cl-,反應寫成Cl2+S2O32-→SO42-+Cl-,根據得失電子守恒配平,4Cl2+S2O32-→2SO42-+8Cl-,根據原子守恒和電荷守恒,尾氣吸收時的離子方程式為4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+。
(7)選擇微型實驗裝置的優點有:簡化實驗裝置、節約成本;試劑用量少、能源消耗少;節省空間,縮短實驗時間;減少污染等。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:
【題目】(1)①圖I表示10mL量筒中液面的位置,A與B,B與C刻度間相差1mL,如果刻度A數值為4,則量筒中液體的體積是①,由于放置位置不當讀數時俯視,讀出的數值為②則①②的正確數值為__________________
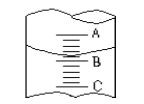
A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2ml D.①4.8mL、②小于4.8mL
②實驗室需配制1mol·L-1的NaOH溶液220mL,在用托盤天平稱取NaOH固體時,天平讀數為________填代號,下同)。
A.大于8.8g B.小于8.8g C.8.8g
(2)表示溶液濃度的方法通常有兩種;溶液中溶質的質量分數(W)和物質的量濃度 (c),因此在配制溶液時,根據不同的需要,有不同的配制方法。請完成下列填空題。
Ⅰ.用10%(密度為1.01g·cm3-)的氫氧化鈉溶液配制成27.5g 2%的氫氧化鈉溶液。
①計算:需_________g10%(密度為1.01g·cm3-)的氫氧化鈉溶液
②量取:用量筒量取10%的氫氧化鈉溶液_________mL
Ⅱ.把98%(密度為1.84g·cm3-)的濃硫酸稀釋成2mol/L的稀硫酸100ml,回答下列問題:
①需要量取濃硫酸_______ mL
②下列實驗操作使配制的溶液濃度偏低的是__________
A.容量瓶洗滌后未干燥
B.量取溶液時,仰視刻度線
C.裝入試劑瓶時,有少量溶液濺出
D.沒有洗滌燒杯和玻璃棒
E.定容時,加水不慎超出刻度線,又倒出一些
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列溶液中的微粒濃度關系不正確的是
A. pH=8.3的某酸式鹽NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物質的量濃度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在Al2 (SO4 )3 、K2 SO4 和明礬的混合溶液中,如果c(SO4 2- )等于0.2 mol/L,當加入等體積的0.2 mol/L 的KOH溶液時,生成的沉淀恰好溶解,則原混合溶液中K + 的物質的量濃度為
A. 0.2 mol/L B. 0.25 mol/L C. 0.45 mol/L D. 0.225 mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
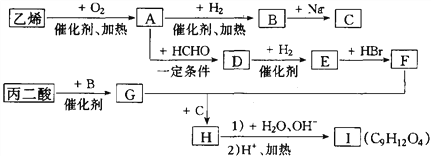
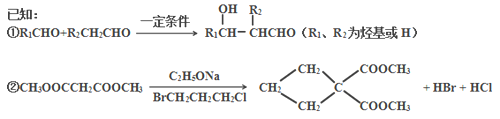
【題目】由乙烯和丙二酸等物質合成I,合成路線如下:
請回答下列問題:
(1)丙二酸的結構簡式是_________。
(2)有機物D的分子式為C5H10O4,其官能團的名稱是__________。
(3)寫出A→B的化學反應方程式______________________________________。
(4)E→F的反應類型是______________。
(5)在一定條件下,丙二酸與乙二醇通過發生縮聚反應生成高分子化合物。寫出該高分子化合物的化學式______________。
(6)I的同分異構體中屬于芳香族化合物且滿足下列條件的有_____種。
①苯環上有4個取代基;②與FeCl3溶液發生顯色反應;③每種同分異構體1 mol能與1 mol碳酸鈉發生反應,也能與足量金屬鈉反應生成2molH2;④一個碳原子連接2個或2個以上羥基不穩定。
其中苯環上的一氯代物只有一種的是___________________。(寫出其中一種的結構簡式)
(7)丙二酸可由乙烯、甲醛為原料制得(其它無機試劑任選)。請模仿并畫出合成路線圖。___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com