
| A. |  反應Ⅰ:△H>0,P2>P1 | B. |  反應Ⅱ:△H<0,T1<T2 | ||
| C. | 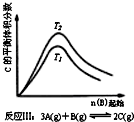 反應Ⅲ:△H<0,T2>T1;或△H>0,T2<T1 | D. | 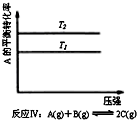 反應Ⅳ:△H<0,T2<T1或△H>0,T2>T1 |
分析 反應Ⅰ:升高溫度,A的轉化率降低,平衡向逆反應移動,據此判斷反應熱效應;
該反應正反應是氣體體積減小的反應,增大壓強平衡向正反應方向移動,根據壓強對A的轉化率影響判斷壓強大小;
反應Ⅱ:由圖象可以看出T1>T2,升高溫度C的物質的量減少;
反應Ⅲ:中溫度的高低與溫度對平衡移動的影響有關;
反應Ⅳ:由圖象可以看出T2條件下A的轉化率大,因此當T2>T1時,說明升高溫度平衡向正反應方向進行,正反應為吸熱反應△H>0,當T1>T2時,說明降低溫度平衡向正反應方向進行,正反應為放熱熱反應△H<0.
解答 解:A.反應Ⅰ:升高溫度,A的轉化率降低,平衡向逆反應移動,所以正反應為放熱反應,故△H<0,反應Ⅰ的特點是正反應方向為氣體體積減小的方向,壓強增大,平衡向正反應移動,A的轉化率應增大,所以p2>p1,故A錯誤;
B.關于反應Ⅱ由圖象可以看出T1條件下達到平衡所用的時間少,所以T1>T2,而在T1條件下達平衡時n(C)小,所以說明低溫有利于C的生成,故它主要的正反應為放熱反應△H<0,故B錯誤;
C.關于反應Ⅲ,由圖象可以看出,T2條件下C的平衡體積分數大,因此當T2>T1時正反應為吸熱反應△H>0,而當T2<T1時正反應為放熱反應△H<0,故C錯誤;
D.關于反應Ⅳ,由圖象可以看出T2條件下A的轉化率大,因此當T2>T1時,說明升高溫度平衡向正反應方向進行,正反應為吸熱反應△H>0,當T1>T2時,說明降低溫度平衡向正反應方向進行,正反應為放熱熱反應△H<0,故D正確.
故選D.
點評 本題考查外界條件對化學平衡的影響,題目難度中等,本題注意分析圖象中曲線的變化趨勢,結合方程式的特征以及外界條件對平衡移動的影響分析.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ④⑤⑥ | C. | ①②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 50mL 0.50mol/L的鹽酸和50mL 0.55mol/L的燒堿溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,試回答下列問題:
50mL 0.50mol/L的鹽酸和50mL 0.55mol/L的燒堿溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50mL 1.5mol•L-1的CaCl2溶液 | B. | 100mL 3mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 3mol•L-1的KCl溶液 | D. | 50mL 2mol•L-1的FeCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com