
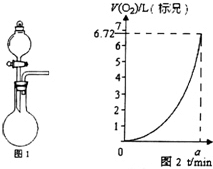
 某同學探究KMnO4溶液和H2O2的反應.
某同學探究KMnO4溶液和H2O2的反應.分析 (1)Mn元素的化合價由+7價降低為+4價,O元素的化合價由-1價升高為0;
(2)結合元素的化合價變化及氧化劑的氧化性大于氧化產物的氧化性分析;
(3)分液漏斗可控制液體的流速;
(4)結合v=$\frac{△n}{△t}$計算,由圖可知氧氣的物質的量增大,曲線斜率增大,則反應速率加快.
解答 解:(1)Mn元素的化合價由+7價降低為+4價,O元素的化合價由-1價升高為0,由電子、電荷及原子守恒可知,離子反應為2MnO4-+3H2O2=2MnO2+3O2↑+2H2O+2OH-,
故答案為:2;3;2;3;2;2;
(2)a.H2O2作為還原劑,被氧化,氧化產物為O2,故錯誤;
b.由氧化劑的氧化性大于氧化產物的氧化性可知氧化性:MnO4->O2,故正確;
c.每生成lmolO2轉移2mol電子,故錯誤;
d.該反應中O元素的化合價升高,只體現H2O2有還原性,故錯誤;
故答案為:b;
(3)為實現反應可控,應將H2O2放入中分液漏斗中,故答案為:分液漏斗;
(4)由圖可知,amin生成氧氣為$\frac{6.72L}{22.4L/mol}$=0.3mol,v=$\frac{△n}{△t}$=$\frac{0.3}{a}$mol/min,由圖可知氧氣的物質的量增大,曲線斜率增大,則反應速率加快,則曲線所表示的含義為:隨著反應的進行,生成O2的速率逐漸加快,可知①該反應為放熱反應,產生的熱量使溫度升高,加快反應速率,②反應生成的MnO2起催化作用,
故答案為:$\frac{0.3}{a}$;逐漸加快;該反應為放熱反應,產生的熱量使溫度升高,加快反應速率;反應生成的MnO2起催化作用.
點評 本題考查氧化還原反應及反應速率,為高頻考點,把握反應中元素化合價變化及圖象分析為解答的關鍵,側重分析與應用能力的綜合考查,題目難度不大.


 輕巧奪冠周測月考直通名校系列答案
輕巧奪冠周測月考直通名校系列答案科目:高中化學 來源: 題型:選擇題
| A. | 向NaOH溶液中通入過量CO2氣體:2OH-+CO2═CO32-+H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-═NH3•H2O | |
| C. | 向NaClO溶液中通入少量SO2氣體:ClO-+SO2+H2O═SO42-+Cl-+2H+ | |
| D. | 2 mol•L-1的NaAlO2溶液和5 mol•L-1的鹽酸溶液等體積混合均勻:2AlO2-+5H+═A1(OH)3↓+Al3++H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 二氧化碳溶于水能部分電離,故二氧化碳屬于弱電解質 | |
| B. | 氯化鈉溶液在電流作用下完全電離成鈉離子和氯離子 | |
| C. | 硫酸鋇難溶于水,但硫酸鋇屬于強電解質 | |
| D. | 弱電解質的電離平衡常數與濃度、溫度等條件有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
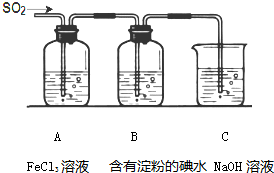 某興趣小組探究SO2氣體還原Fe3+、I2,他們使用的藥品和裝置如圖所示:
某興趣小組探究SO2氣體還原Fe3+、I2,他們使用的藥品和裝置如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 發酵粉中主要含有氫氧化鈉,能使焙制出的糕點疏松多孔 | |
| B. | 碘鹽中的碘可以直接用淀粉檢驗 | |
| C. | 硫酸氫鈉屬于鹽類,其水溶液顯中性 | |
| D. | 碳酸氫鈉可以用于治療胃酸過多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com