
【題目】下圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系,已知B、C、D、E是非金屬單質,且在常溫常壓下都是氣體,化合物G的焰色反應為黃色,化合物I和J通常狀況下呈氣態;反應①式化工生產中的一種重要固氮反應. 請回答下列問題: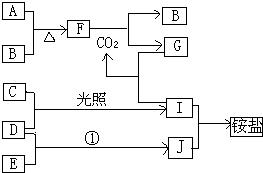
(1)、 A、B、C、D、E、F、G、I、J各為什么物質?
(2)寫出下列物質間反應的化學方程式:A和B,F和CO2 , D和E,I和J.
(3)寫出化合物G與I反應的離子方程式.
【答案】
(1)Na;O2;Cl2;H2;N2;Na2O2;a2CO3;HCl;NH3
(2)2Na2O2+2CO2=2Na2CO3+O2;N2+3H2![]() 2NH3;HCl+NH3=NH4Cl
2NH3;HCl+NH3=NH4Cl
(3)CO32﹣+2H+=CO2↑+H2O
【解析】解:反應①是化工生產中的一種重要固氮反應,證明是氮氣和氫氣合成氨的反應,判斷J為NH3,化合物I和J通常狀況下呈氣態,CD是非金屬單質,依據反應條件是光照,推斷為氫氣和氯氣生成氯化氫的反應,判斷D為H2,E為N2,C為Cl2,I為HCl,J為NH3;化合物G的焰色反應為黃色說明含鈉元素,G與HCl反應生成CO2,說明G為Na2CO3,氣體單質B和A反應生成的F可以與二氧化碳反應生成碳酸鈉和氣體B單質,說明F中 含有鈉元素,證明A為金屬鈉,推斷B為O2,F為Na2O2;(1)根據上面的分析可知,A為Na,B為O2,C為Cl2,D為H2,E為N2,F為Na2O2,G為Na2CO3,I為HCl,J為NH3,
所以答案是:Na;O2;Cl2;H2;N2;Na2O2;a2CO3;HCl;NH3;(2)A和B的化學方程式為,F和CO2的化學方程式為2Na2O2+2CO2=2Na2CO3+O2,D和E的化學方程式為N2+3H2 ![]() 2NH3,I和J的化學方程式為HCl+NH3=NH4Cl,
2NH3,I和J的化學方程式為HCl+NH3=NH4Cl,
所以答案是:2Na2O2+2CO2=2Na2CO3+O2;N2+3H2 ![]() 2NH3;HCl+NH3=NH4Cl;(3)化合物G與I反應的離子方程式為CO32﹣+2H+=CO2↑+H2O,所以答案是:CO32﹣+2H+=CO2↑+H2O.
2NH3;HCl+NH3=NH4Cl;(3)化合物G與I反應的離子方程式為CO32﹣+2H+=CO2↑+H2O,所以答案是:CO32﹣+2H+=CO2↑+H2O.


科目:高中化學 來源: 題型:
【題目】過氧化鈣可以用于改善地表水質,處理含重金屬粒子廢水和治理赤潮,也可用于應急供氧等.工業上生產過氧化鈣的主要流程如下: 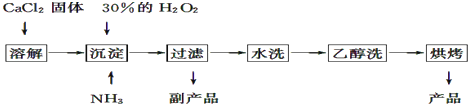
已知CaO28H2O呈白色,微溶于水,不溶于醇類和乙醚等,加熱至350℃左右開始分解放出氧氣.
(1)用上述方法制取CaO28H2O的化學方程式是;
(2)該制法的副產品為(填化學式),為了提高副產品的產率,結晶前要將溶液的pH調整到合適范圍,可加入的試劑是;
(3)檢驗“水洗”是否合格的方法是;
(4)測定產品中CaO2的含量的實驗步驟:
第一步:準確稱取a g產品于有塞錐形瓶中,加入適量蒸餾水和過量的b g KI晶體,再滴入適量2molL﹣1的鹽酸溶液,充分反應.
第二步:向上述錐形瓶中加入幾滴淀粉溶液.
第三步:逐滴加入濃度為c molL﹣1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液V mL.
已知:I2+2S2O32﹣═2I﹣+S4O62﹣
①第一步反應的離子方程式為;
②第三步中盛放Na2S2O3溶液的儀器名稱是 , 反應完全時的現象為
③產品中CaO2的質量分數為(用字母表示).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】食品安全已成為近幾年來社會關注的熱點問題之一。下列有關食品添加劑使用的說法正確的是( )
A.為了調節食品色澤,改善食品外觀,使用工業色素蘇丹紅
B.為了提高奶粉中氮含量,加入適量的三聚氰胺
C.為了防止食品腐敗,加入適量苯甲酸鈉以達到阻抑細菌繁殖的作用
D.食鹽是咸味劑,無防腐作用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在四片玻璃片上分別滴有下列溶液,當氨氣靠近各玻璃片時,有白煙產生的是( )
①濃硫酸 ②濃磷酸 ③濃硝酸 ④濃鹽酸
A. ①② B. ①③ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2010年5月1日上海世博會隆重開幕,世博會的環保概念是人們關心的話題,環保材料更為世人矚目,其中聚碳酸酯是用得較多的材料。聚碳酸酯的結構簡式如圖所示,下列說法正確的是( )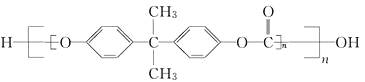
A.它在結構上可以看成由碳酸和另一有機物通過縮聚反應而成
B.該有機物是一種高分子化合物,肯定易溶于水
C.它是一種純凈物,屬于酯類物質
D.它耐強酸、強堿,不可與強氧化劑發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】密度為0.910g/cm3的氨水,質量分數為25.0%,該氨水用等體積的水稀釋后,所得溶液的質量分數為
A. 等于12.5% B. 大于12.5% C. 小于12.5% D. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數值,下列說法不正確的是( )
A.10 g D216O中所含中子數為5NA
B.標準狀況下,22.4 L乙烷中所含共價鍵數目為7NA
C.7.8g Na2O2中所含陰、陽離子總數目為0.4NA
D.密閉容器中,1 mol N2和3 mol H2充分反應后,容器中的分子數一定大于2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是一個巨大的化學資源寶庫,利用海水可以獲得很多化工產品.
(1)海水中制得的氯化鈉可用于生產燒堿及氯氣.反應的離子方程式是 .
(2)利用制鹽后的鹽鹵提取溴的工藝流程如下(部分操作和條件已略去): ![]()
將Br2與Na2CO3反應的化學方程式補充完整:Br2+Na2CO3═NaBrO3++
(3)鹽鹵蒸發冷卻后析出鹵塊的主要成分是MgCl2 , 此外還含Fe2+、Fe3+、Mn2+等離子.以鹵塊為原料制得鎂的工藝流程如下(部分操作和條件已略去): 
生成氫氧化物沉淀的pH
物質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步驟②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的離子反應方程式是 .
③步驟③需在HCl保護氣中加熱進行,其原理涉及的離子方程式為 .
④NaClO還能除去鹽鹵中的CO(NH2)2 , 生成鹽類物質和能參與大氣循環的物質.除去0.1mol CO(NH2)2時消耗NaClOg.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)用于漂白織物、纖維、紙漿,具有對纖維損傷小的特點.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),經測定25℃時各組分含量隨pOH變化情況如圖所示(Cl﹣沒有畫出),此溫度下,下列分析錯誤的是( ) 
A.HClO2的電離平衡常數的數值Ka=10﹣6
B.亞氯酸鈉在堿性條件下較穩定
C.pH=7時,溶液中含氯微粒的濃度大小為:c(HClO2)>c(ClO2﹣)>c( ClO2)>c( Cl﹣)
D.同濃度的HClO2溶液和NaClO2溶液等體積混合,則混合溶液中有c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com