
【題目】密度為d g·cm-3的溶液V mL含有摩爾質量為M的溶質m g,其物質的量濃度為c mo/L,質量分數為W%,下列表示式不正確的是
A.W%=![]() %B.d=
%B.d=![]() C.c=
C.c=![]() D.m=
D.m=![]()
 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案科目:高中化學 來源: 題型:
【題目】根據下圖所示實驗,回答問題:
(1)實驗①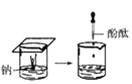 觀察到的現象是________________________。實驗②
觀察到的現象是________________________。實驗②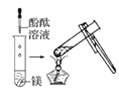 觀察到的現象是________________________。
觀察到的現象是________________________。
(2)實驗③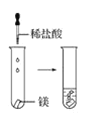 觀察到的現象是________________________。實驗④
觀察到的現象是________________________。實驗④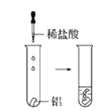 觀察到的現象是________________________。
觀察到的現象是________________________。
(3)由上述實驗,你能得出的結論是________________________。
(4)請總結同周期元素金屬性的變化規律__________,并用原子結構解釋其原因_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構確定:
①測定實驗式:某含C、H、O三種元素的有機物,經燃燒分析實驗測定其碳的質量分數是64.86%,氫的質量分數是13.51%,則其實驗式是 __________________;
②確定分子式:如圖是該有機物的質譜圖,則其相對分子質量為 ____;分子式為 _____;

③結構式的確定:經測定,該有機物在核磁共振氫譜中出現四個峰,其氫原子個數比為6∶1∶2∶1;該有機物與金屬鈉反應產生氫氣;則A的結構簡式為 _______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
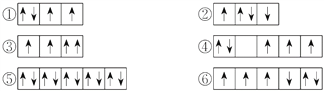
(2)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(3)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
【答案】 ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】試題分析:(1)在一個原子軌道里,最多只能容納2個電子,而且它們的自旋狀態相反,稱為泡利不相容原理;當電子排布在同一個能級的不同軌道時,基態原子中的電子總是單獨優先占據一個軌道,而且自旋狀態相同,稱為洪特規則;(2)根據激發態原子核外電子排布式知該元素核外有16個電子,根據能量最低原理分析其基態原子核外電子排;(3)相同電子層上原子軌道能量的高低:ns<np<nd;形狀相同的原子軌道能量的高低:1s<2s<3s<4s……。
解析:(1)在一個原子軌道里,最多只能容納2個電子,而且它們的自旋狀態相反,稱為泡利不相容原理,所以違反泡利不相容原理的有③;當電子排布在同一個能級的不同軌道時,基態原子中的電子總是單獨優先占據一個軌道,而且自旋狀態相同,稱為洪特規則,所以違反洪特規則的有②④⑥;(2)根據激發態原子核外電子排布式知該元素核外有16個電子,為S元素;根據能量最低原理,其基態原子核外電子排是1s22s22p63s23p4;S元素最外層有6個電子,所以最高價是+6價,最高價氧化物對應水化物的化學式是H2SO4;(3)相同電子層上原子軌道能量的高低:ns<np<nd;形狀相同的原子軌道能量的高低:1s<2s<3s<4s……,多電子原子的原子軌道按軌道能量由低到高順序是①④⑥③②⑤。
【題型】綜合題
【結束】
18
【題目】四種短周期元素A、B、C、D的性質或結構信息如下。
信息①:原子半徑大小:A>B>C>D
信息②:四種元素之間形成的某三種分子的比例模型及部分性質:
|
|
|
是地球上最常見的物質之一,常溫為液態,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分 | 無色,無味且易燃,是21世紀的主要能源 | 弱酸,有強氧化性,可以用于消毒殺菌 |
請根據上述信息回答下列問題。
(1)甲、乙、丙中含有的共同元素是 (填名稱)。
(2)B元素在周期表中的位置為 。
(3)上述元素的原子M層有一個未成對p電子的是 (填元素符號)。
(4)丙的電子式為 ,丙與SO2水溶液可發生氧化還原反應,生成兩種強酸,化學反應方程式為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色的混合氣體甲中可能含有NO2、NO、CO2、O2、NH3、N2中的幾種,將100mL甲氣體經過如圖所示的實驗裝置進行處理,結果得到酸性溶液,而幾乎無氣體剩余,則甲氣體的組成為(不考慮Na2O2與NO2、NO的反應)( )
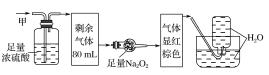
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【答案】B
【解析】
該氣體無色,說明其中不含NO2;氣體通過濃硫酸體積減小,說明其中有NH3;氣體通過足量Na2O2后顯紅棕色,說明其中含有CO2和NO,故不含O2;最后通入水中無氣體剩余,說明其中不存在N2,選項B正確,故答案為B。
【題型】單選題
【結束】
19
【題目】A、B、C、D是四種常見氣體單質。E的相對分子質量比F小16,且F為紅棕色。有關的轉化關系如圖所示(反應條件與部分反應的生成物略去)。
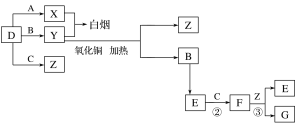
請回答下列問題:
(1)D的化學式為__,Y的化學式為__,E的化學式為__。
(2)Y與氧化銅反應,每生成1molB消耗3mol氧化銅,該反應的化學方程式為__。
(3)Y與E在一定條件下可反應生成B和Z,這是一個具有實際意義的反應,可消除E對環境的污染,該反應的化學方程式為__。
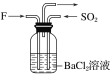
(4)氣體F和氣體SO2在通常條件下同時通入盛有BaCl2溶液的洗氣瓶中(如圖所示),洗氣瓶中是否有沉淀生成?__,理由是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容。據此下列說法不正確的是
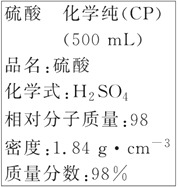
A.包裝箱上應貼上腐蝕性液體的危險品標志圖標
B.1 mol Al與足量該硫酸反應產生3 g氫氣
C.配制90 mL 4.6 mol·L-1的稀硫酸需取該硫酸25 mL
D.配制500 mL 4.6 mol·L-1的稀硫酸時,定容時仰視刻度線導致濃度偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
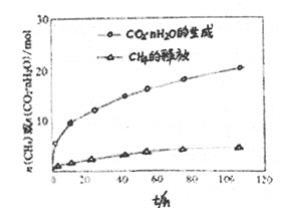
【題目】一定條件下,CH4和CO2都能與H2O形成籠狀結構的水合物晶體,CH4與H2O形成的水合物俗稱“可燃冰”。
(1)“可燃冰”晶體中平均每46個H2O分子構建8個籠,其中6個籠分別容納1個CH4分子,另外2個籠分別容納1個H2O分子,則“可燃冰”平均組成可表示為________(填化學式)。
(2)已知:
CO2(g)+nH2O(l)=CO2·nH2O(s) △H=-57.98kJ·moI-1
CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49kJ·mol-1
反應CO2(g)+CH4·nH2O(s)=CH4(g)+CO2·nH2O(s)的△H=________kJ·mol-1
(3)科學家提出用CO2“置換”CH4開采海底“可燃冰”的設想,提出該設想的理論依據是________。
(4)圖中顯示,CO2·nH2O的生產速率明顯大于 CH4·nH2O釋放出的速率,其原因是________。
(5)利用CO2的弱氧化性,開發了丙烷氧化脫氫制丙烯的新工藝。該工藝可采用鉻的氧化物為催化劑,其反應機理如圖。
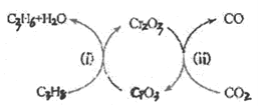
①反應(i)的化學方程式為________。
②該工藝可以有效消除催化劑表面的積炭,維持催化劑活性,原因是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向200mL FeBr2溶液中逐漸通入C12,其中n(Fe3+)、n(Br2)隨通入n(Cl2)的變化如圖所示,下列說法不正確的是( )

A.氧化性強弱:Br2>Fe3+
B.由圖可知,該FeBr2溶液的濃度為1molL─1
C.n(Cl2)= 0.12 mol時,溶液中的離子濃度有c(Fe3+):c(Br-)=1:8
D.c(FeBr2):c(Br2)= 1: 1時,反應的離子方程式:2Fe3++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖為與水相關的部分轉化關系(水作反應物或生成物,部分產物和反應條件未列出).下列說法錯誤的是( )
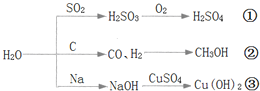
A.圖中所示的反應均為氧化還原反應
B.途徑![]() 是硫酸型酸雨的形成的重要途徑
是硫酸型酸雨的形成的重要途徑
C.工業上可用途徑![]() 先制取水煤氣,再合成甲醇等有機物
先制取水煤氣,再合成甲醇等有機物
D.把金屬鈉投入到硫酸銅溶液中,發生途徑![]() 反應,反應不生成銅單質
反應,反應不生成銅單質
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com