
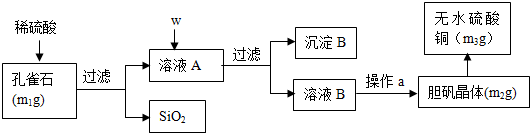
分析 m1g孔雀石的主要成分為Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2),加入稀硫酸過濾得到濾渣二氧化硅和溶液A為硫酸銅、硫酸亞鐵、硫酸鐵,加入W為過氧化氫氧化亞鐵離子為鐵離子,加入氧化銅調節溶液的PH沉淀鐵離子,過濾得到沉淀B為氫氧化鐵和過量的氧化銅,溶液B為硫酸銅溶液,通過蒸發濃縮、冷卻結晶、過濾洗滌、干燥得到硫酸銅晶體m2g,受熱失去結晶水得到硫酸銅固體m3g,
(1)根據推導可知,E是二氧化碳,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳;
(2)流程中分析可知,W為加入氧化劑氧化亞鐵離子,加入氧化銅調節溶液PH使鐵離子全部沉淀,過濾得到沉淀B為氫氧化鐵和氧化銅;
(3)從溶液中獲得硫酸銅晶體,直接加熱會導致硫酸銅失去結晶水,應該采用加熱濃縮、冷卻結晶、過濾、自然干燥的操作方法;過濾中需要玻璃棒引流;
(4)Fe3+的檢驗方法為:取待測液于試管中,向待測溶液中加入KSCN溶液,溶液立刻變成紅色說明溶液中有Fe3+,即Fe3++3SCN-?Fe(SCN)3;根據常見離子的顏色判斷Fe3+(黃色);Fe3+與OH-反應生成紅褐色Fe(OH)3;Fe2+的檢驗方法為:再取待測液于試管中,加KSCN溶液沒有明顯現象,加入氯水溶液變成紅色,說明溶液只有Fe2+;根據常見離子的顏色判斷Fe2+(淺綠色);向Fe2+溶液中加入NaOH溶液后,觀察到生成的白色沉淀迅速變成灰綠色,最后變成紅褐色;Fe2+能使酸性KMnO4溶液褪色,注意混合溶液中亞鐵離子檢驗需要注意現象的相互干擾,據此即可解答,A中含有鐵離子和亞鐵離子;
(5)應稱量坩堝的質量,坩堝和晶體的質量,加熱后坩堝的質量,加熱后再稱量一次坩堝的質量,判斷質量是否發生變化,共稱量4次;
a.加熱溫度過高,會導致硫酸銅分解,質量變化較大;
b.膽礬晶體的顆粒較大,會導致晶體解熱分解不完全,質量變化偏小,結果偏小;
c.加熱后放在空氣中冷卻,會吸收空氣中的水重新形成晶體,結果偏小;
d.膽礬晶體濺出,導致結晶水含量增大;
(6)膽礬中的銅元素來自樣品和調節pH時加入的氧化銅.
解答 解:(1)根據推導可知,E是二氧化碳,堿式碳酸銅和硫酸反應生成硫酸銅、水和二氧化碳,反應的離子方程式為:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,
故答案為:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑;
(2)按試劑加入順序,w所代表的試劑依次為加入氧化劑過氧化氫氧化亞鐵離子,不引入其他雜志離子,加入氧化銅調節溶液PH使鐵離子全部沉淀,過濾得到沉淀B為Fe(OH)3、CuO,
故答案為:H2O2溶液、CuO;Fe(OH)3、CuO;
(3)從溶液C中獲得硫酸銅晶體,直接加熱蒸干會導致硫酸銅失去結晶水,應該采用的操作方法為:加熱濃縮、冷卻結晶、過濾、自然干燥,除燒杯、漏斗之外過濾還需要另一玻璃儀器為玻璃棒,該儀器在此操作中的主要作用是引流,
故答案為:冷卻結晶,自然干燥;引流;
(4)溶液A中含亞鐵離子和鐵離子,
a、NaOH溶液,向Fe2+溶液中加入NaOH溶液后,Fe2+與OH-反應生成Fe(OH)2,Fe2++2OH-=Fe(OH)2↓,Fe(OH)2不穩定易被氧氣氧化為Fe(OH)3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,白色的Fe(OH)2沉淀變成紅褐色Fe(OH)3,向Fe2+溶液中加入NaOH溶液后,觀察到生成的白色沉淀迅速變成灰綠色,最后變成紅褐色;Fe3+與OH-反應Fe3++3OH-=Fe(OH)3↓,生成紅褐色Fe(OH)3,兩者反應現象干擾,不能檢驗該溶液中存在Fe2+,故a錯誤;
b、Na2CO3(aq) 和亞鐵離子生成沉淀,和鐵離子雙水解生成氫氧化鐵沉淀和二氧化碳,溶液渾濁不能檢驗亞鐵離子,故b錯誤;
c、淀粉KI(aq) 和鐵離子發生氧化還原反應生成碘單質和亞鐵離子,溶液顏色相近不能鑒別亞鐵離子,故c錯誤;
d、酸性KMnO4(aq),因為Fe2+具有較強的還原性能使酸性KMnO4溶液褪色,Fe3+不能,故能夠用酸性KMnO4溶液鑒別Fe2+和Fe3+,故d正確;
如果測定Fe2+的含量,需要用容量瓶配制某標準溶液,加水到離刻度線2~3cm處改用膠頭滴管滴加蒸餾水,直到凹液面的最低線與刻度線相平,
故答案為:d;加水到離刻度線2~3cm處改用膠頭滴管滴加蒸餾水,直到凹液面的最低線與刻度線相平;
(5)測定所得膽礬(CuSO4•xH2O)中結晶水x值,應稱量坩堝的質量,坩堝和晶體的質量,加熱后坩堝的質量,加熱后再稱量一次坩堝的質量,判斷質量是否在誤差允許范圍內及兩次值是否相差不超過0.1g,所以至少稱量4次;
a.加熱溫度過高,會導致硫酸銅分解,質量變化較大,導致結果偏大,故a正確;
b.膽礬晶體的顆粒較大,會導致晶體解熱分解不完全,質量變化偏小,結果偏小,故b錯誤;
c.加熱后放在空氣中冷卻,會吸收空氣中的水重新形成晶體,導致測定結果偏小,故c錯誤;
d.加熱膽礬晶體時有晶體從坩堝中濺出,導致測定的結晶水的質量偏大,測定的x值偏大,故d正確;
故答案為:ad;
(6)向溶液中加入CuO調節溶液的pH,沉淀II為Fe(OH)3,所以膽礬中的銅元素不是都來自樣品,因此該小組一位同學根據實驗結果求出樣品中CuO的質量分數偏大,
故答案為:在除雜過程中加入了CuO,會使結果偏大.
點評 本題考查了物質制備的過程分析判斷,主要是雜質離子的分離、離子性質的理解應用、實驗誤差分析應用,明確流程為解題關鍵,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na+、K+、HCO3-、Cl- | B. | K+、NH4+、Cl-、SO42- | ||
| C. | K+、Cu2+、SO42、Cl- | D. | Mg2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
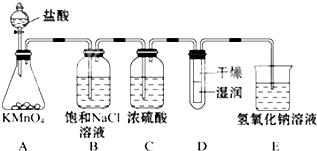 工業上將純凈干燥的氯氣通入到0.5mol•L-1NaOH溶液中得到漂白水.某同學想在實驗室探究Cl2性質并模擬制備漂白水,如圖是部分實驗裝置.已知KMnO4與濃鹽酸反應可以制取Cl2.(注:裝置D中布條為紅色)
工業上將純凈干燥的氯氣通入到0.5mol•L-1NaOH溶液中得到漂白水.某同學想在實驗室探究Cl2性質并模擬制備漂白水,如圖是部分實驗裝置.已知KMnO4與濃鹽酸反應可以制取Cl2.(注:裝置D中布條為紅色)查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
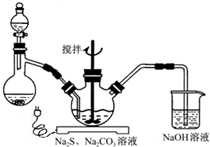 NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題:
NaCN為劇毒無機物.某化學興趣小組查閱資料得知,實驗室里的氰化鈉溶液可使用硫代硫酸鈉溶液進行統一解毒銷毀,他們開展了以下三個實驗,根據要求回答問題: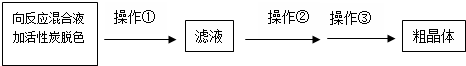
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
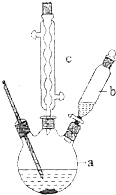 苯乙酸是有機合成的中間產物,下面是它的一種實驗室合成路線:
苯乙酸是有機合成的中間產物,下面是它的一種實驗室合成路線: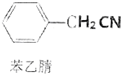 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$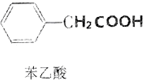 +NH4HSO4
+NH4HSO4查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 圖為實驗室制溴苯的實驗裝置圖,請根據圖回答下列問題
圖為實驗室制溴苯的實驗裝置圖,請根據圖回答下列問題 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
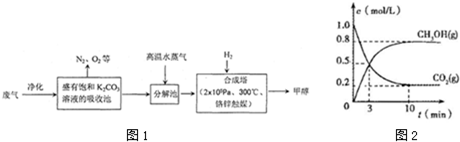
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com