
電子級鈷的氧化物用于半導體工業和電子陶瓷等領域,是一種純度很高的氧化物。其工業制取流程如下:
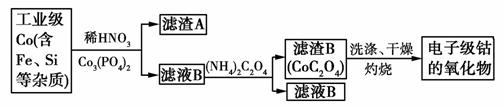
(1)實驗室過濾所需的儀器有鐵架臺、鐵圈、燒杯、________和漏斗。
(2)濾渣A的成分除過量的Co3(PO4)2和Fe(OH)3外還有________(填化學式),加入Co3(PO4)2的目的是__________________。
(3)Co與稀硝酸反應生成Co2+的離子方程式為:_____________。
(4)濾渣B經過反復洗滌、干燥后,進行灼燒,其熱重分析圖如下:
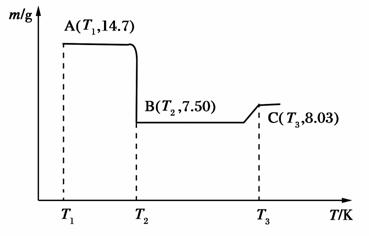
寫出下列化學反應方程式:
①AB段:____________________________________________;
②BC段:____________________________________________。
解析:本題考查電子級鈷的氧化物的制取流程,意在考查考生對化工流程的綜合分析能力。(1)過濾時還需要的儀器為玻璃棒。(2)Si不溶于稀HNO3,因此濾渣A中還含有Si。根據制取流程可知,需要分離出Fe3+,因此加入Co3(PO4)2的目的是調節溶液pH,使Co2+不沉淀,而使Fe3+完全沉淀。(3)Co與稀HNO3發生氧化還原反應:3Co+8H++2NO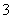 ===3Co2++4H2O+2NO↑。
===3Co2++4H2O+2NO↑。
(4)A點物質為CoC2O4,14.7 g CoC2O4的物質的量為0.1 mol,B、C點物質均為鈷的氧化物,設其化學式為CoxOy,對于B點物質, ×(59x+16y)=7.50,得
×(59x+16y)=7.50,得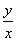 =1,故B點物質為CoO,對于C點物質,
=1,故B點物質為CoO,對于C點物質, ×(59x+16y)=8.03,得
×(59x+16y)=8.03,得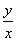 ≈
≈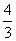 ,故C點物質為Co3O4,故AB段的反應為CoC2O4
,故C點物質為Co3O4,故AB段的反應為CoC2O4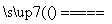 CoO+CO↑+CO2↑;BC段的反應為6CoO+O2
CoO+CO↑+CO2↑;BC段的反應為6CoO+O2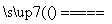 2Co3O4。
2Co3O4。
答案:(1)玻璃棒(1分)
(2)Si(1分) 調節溶液pH,保證Co2+不沉淀,而使鐵離子全部沉淀(3分)
(3)3Co+8H++2NO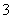 ===3Co2++4H2O+2NO↑(3分)
===3Co2++4H2O+2NO↑(3分)
(4)①CoC2O4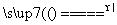 CoO+CO↑+CO2↑(3分)
CoO+CO↑+CO2↑(3分)
②6CoO+O2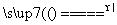 2Co3O4(3分)
2Co3O4(3分)


科目:高中化學 來源: 題型:
煤、石油、天然氣是人類使用的主要能源,同時也是重要的化工原料,下列不屬于以煤、石油和天然氣為主要原料生產的合成材料是
A.塑料 B.合成橡膠 C.淀粉 D.合成纖維
查看答案和解析>>
科目:高中化學 來源: 題型:
CO2的的資源化利用是解決溫室效應的重要途徑。以下是在一定條件下用NH3捕獲CO2生成重要化工產品三聚氰胺的反應: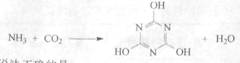
下列有關三聚氰胺的說法正確的是
A、分子式為C3H6N3O3 B、分子中既含極性鍵,又含非極性鍵
C、屬于共價化合物 D、生成該物質的上述反應為中和反應
查看答案和解析>>
科目:高中化學 來源: 題型:
化學是以實驗為基礎的學科,下列有關實驗的描述正確的是( )
A.向兩支分別裝有碳酸鈉和碳酸氫鈉固體的試管中各加幾滴水,前者溫度降低,后者溫度升高
B.向100 mL容量瓶中加入4.0 g NaOH固體,然后加水到刻度線,配制1.0 mol/L的NaOH溶液
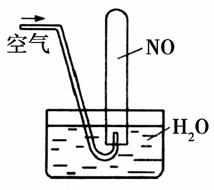
C.向酸性重鉻酸鉀溶液中加NaOH,溶液顏色由橙色慢慢變為黃色
D.如圖所示,隨著空氣的通入,試管內液面會慢慢上升至充滿整支試管,而后液面又下降
查看答案和解析>>
科目:高中化學 來源: 題型:
用NA表示阿伏加德羅常數的值,下列敘述不正確的是( )
A.1 mol BrCl與H2O完全反應生成氯化氫和次溴酸,轉移的電子數為NA
B.鋅與一定濃度的濃硫酸反應,產生標準狀況下SO2和H2的混合氣體22.4 L,鋅失去電子數為2NA
C.常溫常壓下,20 g D2O含有的原子總數為3NA
D.標準狀況下,44.8 L NO與22.4 L O2混合后氣體中分子總數小于2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
下列各組中的離子,能在溶液中大量共存的是
A.K+、H+、SO42-、OH- B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32- D.Na+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
下列方法中,正確的是
A.用濕潤的紅色石蕊試紙檢驗氨氣
B.在樣品溶液中先加入硝酸銀溶液,再加入稀硝酸,若白色沉淀存在,則樣品中含有Cl—
C.將熟石灰和氯化銨混合加熱,可以制備氨氣
D.將燒瓶中的濃氨水加熱
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com