

如右圖所示:右圖為A → E五種含同種元素的物質 相互轉化的關系圖,其中A、B、C、D常溫下都是氣體,D呈紅棕色。按要求回答下列問題:
(1) A物質的電子式 ;B物質是含 鍵
的 分子(填“極性”或者“非極性”)
(2)下列反應的化學方程式為:
①B→C:
②D→E:
(3)實驗室制取B的化學方程式為: ,通常用 來干燥B氣體;
已知B可以與灼熱的氧化銅反應得到A氣體和金屬銅,則該反應的化學方程式為: 。
科目:高中化學 來源: 題型:閱讀理解
 AgOH+H+
AgOH+H+ AgOH+H+
AgOH+H+
| ||
| ||

 門上的固體材料R可以采用
門上的固體材料R可以采用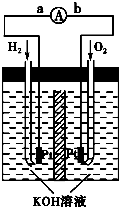 方向為
方向為查看答案和解析>>
科目:高中化學 來源: 題型:
 如右圖所示,U形管內盛有100mL的溶液,按要求回答下列問題:
如右圖所示,U形管內盛有100mL的溶液,按要求回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(12分)在一定條件下,可逆反應A + B![]() mC變化如右圖所示。已知縱坐標表示在不同溫度和壓強下生成物C在混合物中的質量分數,P為反應在T2溫度時達到平衡后向容器加壓的變化情況,問:
mC變化如右圖所示。已知縱坐標表示在不同溫度和壓強下生成物C在混合物中的質量分數,P為反應在T2溫度時達到平衡后向容器加壓的變化情況,問:
⑴溫度T1 T2(填大于、等于或小于)
⑵正反應是 反應(填“吸熱”或“放熱”)
⑶如果A、B、C均為氣體,則m 2(填大于、等于或小于)
⑷當溫度和容積不變時,如在平衡體系中加入一定量的某稀有氣體,
則體系的壓強 (填增大、減小或不變),平衡 移動(填“向正反應方向”、“向逆反應方向”或“不”)
22.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
在一定體積的密閉容器中,進行如下化學反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
CO(g)+H2O(g),其化學平衡常數K和溫度t的關系如下表:
回答下列問題:
(1)該反應的化學平衡常數表達式為K= 。
(2)該反應為 反應(選填“吸熱”、“放熱”)。
(3)能判斷該反應已經達到化學平衡狀態的依據是 (多選扣分)。
A、容器中壓強不變;B、混合氣體中c(CO)不變;C、v正(H2)=v逆(H2O);D、c(CO2)=c(CO)。
(4)某溫度下,平衡濃度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),試判斷此時的溫度為 ℃
23. (12分)在密閉容器中將NO2加熱到某溫度時,進行如下的反應:2NO2![]() 2NO+O2,反應5分鐘后達平衡,測得平衡時各組分的濃度分別為:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。試求:
2NO+O2,反應5分鐘后達平衡,測得平衡時各組分的濃度分別為:c(NO2)=0.06 mol/L,c(NO)=0.24 mol/L。試求:
⑴NO2的轉化率為?
⑵反應前后的壓強比為多少?
⑶在這5分鐘內,用O2來表示的平均反應速率是多少?
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
科學家一直致力于“人工固氮”的新方法研究。
 (1)目前合成氨技術原理為:N2(g) + 3H2(g)
(1)目前合成氨技術原理為:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=—92.4kJ·mol—1。
① 673K,30MPa下,上述合成氨反應中n(NH3)和n(H2)隨
時間變化的關系如右圖所示。下列敘述正確的是 。
A.點a的正反應速率比點b的大
B.點c處反應達到平衡
C.點d和點 e處的n(N2)相同
D.773K,30MPa下,反應至t2時刻達到平衡,則n(NH3)比圖中e點的值大
② 在容積為2.0 L恒容的密閉容器中充入0.80 mol N2(g)和1.60 mol H2(g),反應在673K、30MPa下達到平衡時,NH3的體積分數為20%。該條件下反應N2(g) + 3H2(g)![]() 2NH3(g)的平衡常數K= 。K值越大,表明反應達到平衡時 。(填標號)。
2NH3(g)的平衡常數K= 。K值越大,表明反應達到平衡時 。(填標號)。
A.化學反應速率越大 B.NH3的產量一定越大 C.正反應進行得越完全
 (2)1998年希臘亞里斯多德大學的兩位科學家采用高質子導電性
(2)1998年希臘亞里斯多德大學的兩位科學家采用高質子導電性
的 SCY陶瓷(能傳遞H+),實現了高溫常壓下高轉化率的電
解合成氨。其實驗裝置如圖,陰極的電極反應式 。
(3)根據最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,
N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生下列反應:
N2(g)+ 3H2O(1) ![]() 2NH3(g)+
2NH3(g)+ ![]() O2(g) △H = a kJ·mol—1
O2(g) △H = a kJ·mol—1
進一步研究NH3生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反應的a 0;ΔS 0(填“>”、“<”或“=”);該反應屬于
A.一定自發 B.一定不自發 C.高溫自發 D.低溫自發
②已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
則N2(g)+ 3H2O(1) = 2NH3(g) + ![]() O2(g)ΔH= kJ·mol—1。
O2(g)ΔH= kJ·mol—1。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com