
【題目】NA為阿伏伽德羅常數,下列說法正確的是( )
A.在反應中消耗0.1molCl2,轉移的電子數一定為0.2NA
B.15gCH3+(碳正離子)中含有的電子數為8NA
C.標準狀況下,11.2L乙炔中含共用電子對的數目為1.5NA
D.0.1L 2mol/L的(NH4)2S溶液中含有的S2-數目為0.2NA
【答案】B
【解析】
A.氯氣發(fā)生氧化還原反應可以是自身氧化還原反應,也可以只做氧化劑。
B.1個CH3+(碳正離子)含有8個電子。
C.乙炔中既有碳碳三鍵又有C-H鍵。
D.硫離子為弱根離子,部分發(fā)生水解。
A. 0.1mol氯氣參加氧化還原反應,自身氧化還原反應轉移電子0.1mol,也可以只做氧化劑轉移的電子數為0.2NA,故A錯誤。
B. 1個![]() (碳正離子)含有8個電子,15g
(碳正離子)含有8個電子,15g![]() (碳正離子)的物質的量為1mol,含有電子數為8NA,故B正確。
(碳正離子)的物質的量為1mol,含有電子數為8NA,故B正確。
C. 標準狀況下,11.2L乙炔中共用電子對有碳碳三鍵又有C-H鍵功0.5NA×(3+2)=2.5 NA,故C錯誤。
D.![]() 的(NH4)2S溶液含有硫化銨的物質的量為0.2mol,但是硫離子為弱根離子,部分發(fā)生水解,所以含有的
的(NH4)2S溶液含有硫化銨的物質的量為0.2mol,但是硫離子為弱根離子,部分發(fā)生水解,所以含有的![]() 數目小于0.2NA,故D錯誤。
數目小于0.2NA,故D錯誤。
故選:B。


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】研究NOx之間的轉化具有重要意義。
(1)已知:N2O4(g) ![]() 2NO2(g) ΔH>0 將一定量N2O4氣體充入恒容的密閉容器中,控制反應溫度為T1。
2NO2(g) ΔH>0 將一定量N2O4氣體充入恒容的密閉容器中,控制反應溫度為T1。
①下列可以作為反應達到平衡的判據是________。
A.氣體的壓強不變 B.v正(N2O4)=2v逆(NO2) C.K不變 D.容器內氣體的密度不變 E.容器內顏色不變
②t1時刻反應達到平衡,混合氣體平衡總壓強為p,N2O4氣體的平衡轉化率為75%,則反應N2O4(g) ![]() 2NO2(g)的平衡常數Kp=________(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p·x(B),p為平衡總壓強,x(B)為平衡系統(tǒng)中B的物質的量分數)。
2NO2(g)的平衡常數Kp=________(對于氣相反應,用某組分B的平衡壓強p(B)代替物質的量濃度c(B)也可表示平衡常數,記作Kp,如p(B)=p·x(B),p為平衡總壓強,x(B)為平衡系統(tǒng)中B的物質的量分數)。
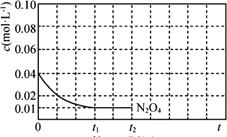
③反應溫度T1時,c(N2O4)隨t(時間)變化曲線如圖,畫出0~t2時段,c(NO2)隨t變化曲線。保持其它條件不變,改變反應溫度為T2(T2>T1),再次畫出0~t2時段,c(NO2)隨t變化趨勢的曲線________。
(2) NO氧化反應:2NO(g)+O2(g)=2NO2(g)分兩步進行,其反應過程能量變化示意圖如圖。
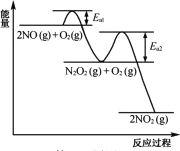
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①決定NO氧化反應速率的步驟是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密閉容器中充入一定量的NO和O2氣體,保持其它條件不變,控制反應溫度分別為T3和T4(T4>T3),測得c(NO)隨t(時間)的變化曲線如圖。轉化相同量的NO,在溫度_____(填“T3”或“T4”)下消耗的時間較長,試結合反應過程能量圖分析其原因____。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖中A~H均為中學化學中常見的物質,A、B、H為氣體,反應①是重要的工業(yè)反應,它們之間有如下轉化關系(反應中生成的水已略去)。
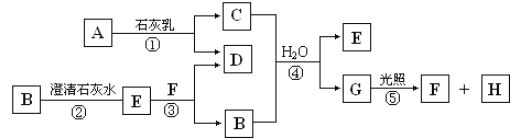
請回答以下問題:
(1)工業(yè)上常利用反應①制取漂白粉,該反應的化學方程式:_____,漂白粉溶于水后,受空氣中的CO2作用,即產生有漂白、殺菌作用的次氯酸,化學反應方程式為____。
(2)A中元素的原子結構示意圖為____。
(3)F在溶液中的電離方程式為_____。
(4)上述反應中屬于氧化還原反應的是___(填寫序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖是某種有機物分子的球棍模型圖。圖中的“棍”代表單鍵或雙鍵,不同大小的“球”代表三種不同的短周期元素的原子。對該有機物的敘述不正確的是( )

A.該有機物可能的分子式為C2HCl3
B.該有機物的分子中一定有![]()
C.該有機物分子中的所有原子在同一平面上
D.該有機物可以由乙烯和氯化氫加成反應得到
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烴A是有機化學工業(yè)的基本原料,其產量可以用來衡量一個國家的石油化工發(fā)展水平,A還是一種植物生長調節(jié)劑,A可發(fā)生如圖所示的一系列化學反應。
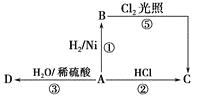
據圖回答下列問題:
(1)寫出A、C、D的結構簡式:
A________,C________,D________。
(2)寫出①②兩步反應的化學方程式,并注明反應類型:
①________________________________(反應類型____________)。
②________________________________(反應類型____________)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A.石灰水中加入過量小蘇打溶液:![]()
B.將銅絲插入足量濃硝酸中:![]()
C.將SO2通入少量氨水中:![]()
D.用雙氧水從酸化的海帶灰浸出液中提取碘:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳熱還原氯化法從鋁土礦中煉鋁具有步驟簡單、原料利用率高等優(yōu)點,其原理如下:
Ⅰ.Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ.3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
(1)寫出反應Ⅰ的化學平衡常數表達式K=_____________,升高溫度,K_______(填增大、減小、不變)。
(2)寫出反應Ⅱ達到平衡狀態(tài)的一個標志_________________________________;結合反應Ⅰ、Ⅱ進行分析,AlCl3在煉鋁過程中的作用可以看作___________。
(3)將1mol氧化鋁與3mol焦炭的混合物加入2L反應容器中,加入2mol AlCl3氣體,在高溫下發(fā)生反應Ⅰ。若5min后氣體總質量增加了27.6g,則AlCl的化學反應速率為_________ mol/(L·min)。
(4)Na2O2具有很強的氧化性。少量Na2O2與FeCl2溶液能發(fā)生反應:____Na2O2+ FeCl2+___H2O→____Fe(OH)3↓+_____FeCl3+____NaCl;已知FeCl2前面系數為6,配平上述化學方程式,并標出電子轉移方向和數目________________。此反應中被還原的元素是____________,氧化產物是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】滴滴涕(DDT)是20世紀60年代以前廣為應用的一種殺蟲劑,其結構簡式為

DDT因其穩(wěn)定性、脂溶性、藥效普適性等特點而大量使用,最終造成環(huán)境污染。下列關于DDT的說法,不正確的是( )
A.DDT也能殺死有益的生物
B.DDT極易溶于水
C.DDT是烴的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,![]() 。向物質的量濃度相同的
。向物質的量濃度相同的![]() 和
和![]() 的混合溶液中滴加
的混合溶液中滴加![]() 溶液產生
溶液產生![]() 、
、![]() 兩種沉淀,溶液中陽離子、陰離子濃度關系如圖所示。
兩種沉淀,溶液中陽離子、陰離子濃度關系如圖所示。
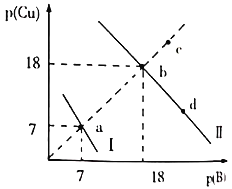
圖中的![]() ,
,![]() 或
或![]() 。下列說法錯誤的是( )
。下列說法錯誤的是( )
A.曲線Ⅰ表示的是Cu2+與OH-濃度關系的曲線
B.該溫度下,![]()
C.升高溫度時,b點會向c點移動
D.向d點對應的溶液中加入對應陰離子的鈉鹽固體,d點向b點移動
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com