
【題目】將3.2 gCu投入到一定濃度的HNO3溶液中,恰好完全反應,產生NO2和NO的混合氣體共 0.08 mol。則原溶液中HNO3的物質的量為( )
A.0.34 molB.0.38 molC.0.28 molD.0.18 mol
 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:
【題目】硫代硫酸鈉晶體(Na2S2O35H2O)俗名“大蘇打”,又稱“海波”.已知Na2S2O35H2O是無色透明晶體,易溶于水,不溶于乙醇.它受熱、遇酸易分解,在空氣中易被氧化.某興趣小組擬制備硫代硫酸鈉晶體(Na2S2O35H2O).反應原理為2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
(1)(圖1)制備Na2S2O3
①儀器b的名稱 , d中盛放的試劑是 .
②b中制備SO2 , 反應的化學方程式 .
③反應開始后,要控制SO2生成速率,可以采取的措施有(寫出一條即可).
(2)分離Na2S2O3并測定含量(圖2)
(I)為了減少產品損失,操作①時需 . 操作②是過濾、洗滌、干燥,其中洗滌操作時用做洗滌劑.干燥操作時(裝置如圖3所示),通入H2的目的是 .
(II)制得的粗晶體中往往含有少量雜質.為了測定粗產品中Na2S2O35H2O的含量,采用在酸性條件下用KMnO4標準液滴定的方法(假設粗產品中的雜質與酸性KMnO4溶液不反應).稱取1.50g粗產品溶于水,用0.20molL﹣1KMnO4溶液(加適量稀硫酸酸化)滴定,當溶液中S2O32﹣全部被氧化時,消耗高錳酸鉀溶液體積40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“堿式”)滴定管中.
②若 , 則達到滴定終點.
③產品中Na2S2O35H2O的質量分數為(保留小數點后一位).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據題意解答
(1)工業上制取硝酸的主要流程圖如圖1: 
(I)工業合成氨的原料是N2和H2 . 裝置A的名稱是;其中N2可從空氣中分離出來,方法是先將空氣 , 然后即可得到;H2可以水和天然氣為原料在催化劑作用下高溫制取,其化學方程式為 .
(II)在原料氣制備過程中混有的CO對催化劑有毒害作用,欲除去原料氣中的CO,可通過如下反應:CO(g)+H2O(g)═CO2(g)+H2(g)來實現.已知1100K時該反應的平衡常數K=0.64,若要使CO的轉化率超過80%,則起始物中c(H2O):c(CO)不低于 .
(2)利用石灰乳來除去硝酸工業的尾氣(含NO、NO2),既能凈化尾氣,又能獲得應用廣泛的Ca(NO2)2 , 其部分工藝流程如圖2.已知NO和NO2按1:1通入堿液中生成亞硝酸鹽. 
(I)上述工藝中采用氣﹣液逆流接觸吸收(尾氣從吸收塔底進入,石灰乳從吸收塔頂噴淋),其目的是;濾渣可循環使用,濾渣的主要成分是(填化學式).
(II)該工藝需控制NO 和NO2 物質的量之比接近1:1.若n(NO):n(NO2)>1:1,則會導致;若n(NO):n(NO2)<1:1,則會導致 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制取氯氣的裝置如圖: 
(1)實驗室制取氯氣的化學方程式為:MnO2+4HCl(濃)=MnCl2++2H2O;氧化劑
(2)實驗室通常用飽和食鹽水吸收雜質 , B瓶盛裝的試劑是
(3)C裝置吸收氯氣用 , 反應的化學方程式為
(4)檢驗氯氣是否泄漏用濕的試紙,若泄漏試紙變色.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】采用高嶺土(主要成分為A12 O3、SiO2和Fe2O3)為原料制備水質凈化劑PAC{[A12(OH)nC16﹣n]m(n<6,m為聚合度)}的過程如圖.下列說法正確的是( ) 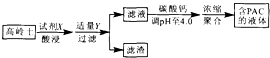
A.試劑X為H2SO4
B.濾渣主要成分為Fe(OH)3、H2 SiO3
C.調pH過高或過低均會減少PAC生成
D.濾液濃縮聚合過程發生了加聚反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】哈佛大學A.Y.Liu教授首次合成類金剛石相氮化碳(β﹣﹣C3N4).福州大學王新晨教授在此基礎上以單氰胺(CH2N2)為原料制得光催化劑類石墨相氮化碳(g﹣C3N4),其單層結構如圖a, 
(1)C,H,N元素電負性從大到小的順序為(填元素符號).
(2)β﹣﹣C3N4熔點、硬度均高于金剛石,其原因為 .
(3)β﹣﹣C3N4和g﹣﹣C3N4中碳原子的雜化軌道類型分別為 .
(4)單氰胺的結構式為 .
(5)g﹣﹣C3N4中存在的作用力為(填序號).
a.離子鍵 b.σ鍵 c.π鍵 d.氫鍵 e.范德華力
(6)g﹣﹣C3N4中摻雜少量鐵元素能提高光催化效果.圖b為g﹣﹣C3N4的另一種單層結構;圖c為Fe3+摻雜前后N﹣1s譜圖(N原子1s的XPS譜圖,圖中峰的強度正比于原子數目),圖c中橫坐標為g﹣﹣C3N4中N﹣1s結合能(原子結合能與穩定性成正比),摻雜Fe3+后,結合能最小的譜線發生了明顯右移.
①Fe3+的價電子軌道表示式為 .
②發生位移的譜線對應的N原子為(填圖b中的序號).
③譜線右移的原因為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合物A含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定條件下可實現如圖所示變化. 
請回答下列問題.
(1)、C、D、G、H 4種物質的化學式為:C、D、G、H .
(2)沉淀F與KOH溶液反應的離子方程式為沉淀E加熱生成B的化學方程式為溶液G與過量稀氨水反應的化學方程式為 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com