
【題目】下列關于反應:xR2++Cl2=yR3++zCl-的說法中正確的是( )
A.x=y,R2+得到電子
B.x=2, Cl2作氧化劑
C.y=z,R3+是還原產物
D.x=z, Cl-是氧化產物
科目:高中化學 來源: 題型:
【題目】銅是重要金屬,Cu的化合物在科學研究和工業生產中具有許多用途,如CuSO4溶液常用作電解液、電鍍液等。請回答以下問題:
(1)CuSO4可由金屬銅與濃硫酸反應制備,該反應的化學方程式為________________________________________________________________________。
(2)CuSO4粉末常用來檢驗一些有機物中的微量水分,其原因是________________________________________________________________________。
(3)SO![]() 中S以sp3雜化,SO
中S以sp3雜化,SO![]() 的立體構型是________。
的立體構型是________。
(4)元素金(Au)處于周期表中的第六周期,與Cu同族,金原子最外層電子排布式為____________。一種銅合金晶體具有立方最密堆積的結構,在晶胞中銅原子處于面心,金原子處于頂點位置,則該合金中銅原子與金原子數量之比為________;該晶體中,原子之間的作用力是________________________________________________________________________。
(5)CuSO4晶體的構成微粒是________和________,微粒間的作用力是________,該晶體屬于________晶體。
(6)上述晶體具有儲氫功能,氫原子可進入到由銅原子與金原子構成的四面體空隙中。若將銅原子與金原子等同看待,該晶體儲氫后的晶胞結構與CaF2的結構相似,該晶體儲氫后的化學式應為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y、Z、W、R、M五種元素,位于元素周期表的前四周期,它們的核電荷數依次增大,有如下信息:
元素 | 相關信息 |
Y | 原子核外有6個不同運動狀態的電子 |
Z | 非金屬元素,基態原子的s軌道的電子總數與p軌道的電子總數相同 |
W | 主族元素,與Z原子的價電子數相同 |
R | 價層電子排布式為3d64s2 |
M | IB族,其被稱作“電器工業的主角” |
請回答下列問題(Y、Z、W、R、M用所對應的元素符號表示):
(1)Z、W元素相比,第一電離能較大的是_____________________,M2+的核外電子排布式為________________________。
(2)M2Z的熔點比M2W的_________(填“高”或“低”) ,請解釋原因___________ 。
(3)N3-和YZ2是等電子體,則N3-的結構式為_________________ 。
(4)WZ2分子中W原子價層電子對數是_____________對,WZ2的VSEPR 模型名稱為______________________,WZ3氣態為單分子,該分子中W原子的雜化軌道類型為__________________;WZ3的三聚體環狀結構如圖1所示,該結構中W原子的雜化軌道類型為__________;該結構中W-Z鍵長有兩類,一類鍵長約140pm,另一類鍵長約為160pm,較短的鍵為___________(填圖2中字母) ,該分子中含有___個σ鍵。
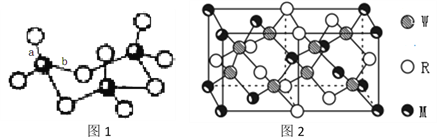
(5)MRW2的晶胞如圖2所示,晶胞參數a=0.524nm、c=1.032nm;MRW2的晶胞中每個M原子與_______個W原子相連,晶體密度ρ=_______g/cm3(只要求列算式,不必計算出數值,阿伏加德羅常數為NA=6.02×1023mol-1)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸鈷[Cox(OH)y(CO3)z]常用作電子材料,磁性材料的添加劑,受熱時可分解生成三種氧化物。為了確定其組成,某化學興趣小組同學設計了如圖所示裝置進行實驗。
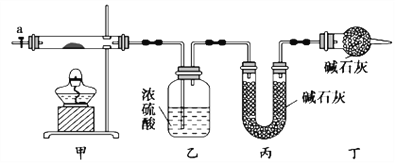
(1)請完成下列實驗步驟:
①稱取3.65g樣品置于硬質玻璃管內,稱量乙、丙裝置的質量;
②按如圖所示裝置組裝好儀器,并檢驗裝置氣密性;
③加熱甲中玻璃管,當乙裝置中____________(填實驗現象),停止加熱;
④打開活塞a,緩緩通入空氣數分鐘后,稱量乙、丙裝置的質量;
⑤計算。
(2)步驟④中緩緩通入空氣數分鐘的目的是_______________。
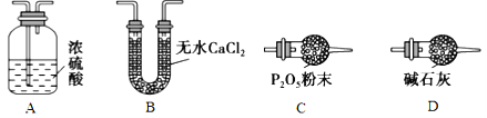
(3)某同學認為上述實驗裝置中存在一個明顯缺陷,為解決這一問題,可選用下列裝置中的_______(填字母)連接在__________(填裝置連接位置)。
(4)若按正確裝置進行實驗,測得如下數據:則該堿式碳酸鈷的化學式為______________。
乙裝置的質量/g | 丙裝置的質量/g | |
加熱前 | 80.00 | 62.00 |
加熱后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加劑,以含鈷廢料(含少量Fe、Al等雜質)制取CoCl2·6H2O的一種工藝如下:
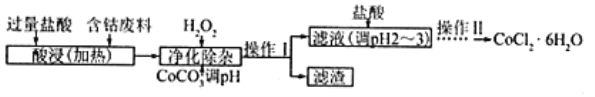
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
開始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①凈除雜質時,加入H2O2發生反應的離子方程式為_____________。
②加入CoCO3調pH為5.2~7.6,則操作Ⅰ獲得的濾渣成分為_____________________。
③加鹽酸調整pH為2~3的目的為_________________。
④操作Ⅱ過程為_______________(填操作名稱)、過濾。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“胃舒平”的主要成分是氫氧化鋁,同時含有三硅酸鎂(Mg2Si3O8·nH2O)等化合物。下列敘述中錯誤的是( )
A. 鎂元素基態原子的核外電子排布式是:1s22s22p63s2
B. 鋁元素原子核外共有5種不同運動狀態的電子
C. 鈉元素離子半徑比鋁離子半徑大
D. 金屬鋁與鈉的最高價氧化物的水化物溶液發生反應的離子方程式為2Al+2OH-+2H2O===2AlO+3H2↑
【答案】B
【解析】試題分析:A.鎂元素基態原子的核外電子排布式是:1s22s22p63s2,A正確;B.鋁元素原子核外共有13種不同運動狀態的電子,B錯誤;C.鈉元素離子半徑比鋁離子半徑大,C正確;D.金屬鋁與鈉的最高價氧化物的水化物溶液發生反應的離子方程式為2Al+2OH-+2H2O===2AlO+3H2↑,D正確,答案選B。
考點:考查核外電子排布、微粒半徑等有關判斷
【題型】單選題
【結束】
17
【題目】(1)以下列出的是一些原子的2p能級和3d能級中電子排布的情況,試判斷哪些違反了泡利原理__________,哪些違反了洪特規則__________。
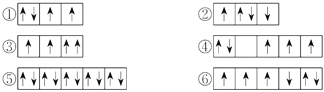
(2)某元素的激發態(不穩定狀態)原子的電子排布式為1s22s22p63s13p33d2,則該元素基態原子的電子排布式為__________;其最高價氧化物對應水化物的化學式是__________。
(3)將下列多電子原子的原子軌道按軌道能量由低到高順序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
軌道能量由低到高排列順序是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期元素A、B、C、D的性質或結構信息如下。
信息①:原子半徑大小:A>B>C>D
信息②:四種元素之間形成的某三種分子的比例模型及部分性質:
|
|
|
是地球上最常見的物質之一,常溫為液態,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分 | 無色,無味且易燃,是21世紀的主要能源 | 弱酸,有強氧化性,可以用于消毒殺菌 |
請根據上述信息回答下列問題。
(1)甲、乙、丙中含有的共同元素是 (填名稱)。
(2)B元素在周期表中的位置為 。
(3)上述元素的原子M層有一個未成對p電子的是 (填元素符號)。
(4)丙的電子式為 ,丙與SO2水溶液可發生氧化還原反應,生成兩種強酸,化學反應方程式為 。
【答案】(1)氫(2)第2周期ⅣA族(3)Cl
(4) HClO+H2O+SO2=H2SO4+HCl
HClO+H2O+SO2=H2SO4+HCl
【解析】試題分析:四種短周期元素A、B、C、D,四種元素之間形成甲、乙、丙三種分子,由信息②,甲分子為V型結構,是地球上最常見的物質之一,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分,故甲為水,乙為正四面體結構,無色無味而易燃,是21世紀的主要能源,乙為甲烷,丙分子有3個不同的原子,至少還有C、H、O中的兩種,且有強氧化性,可以用于消毒殺菌,丙應是HClO,再根據信息①原子半徑大小:A>B>C>D可得,A為Cl元素、B為C元素、C為O元素、D為H元素,據此答題.
解:四種短周期元素A、B、C、D,四種元素之間形成甲、乙、丙三種分子,由信息②,甲分子為V型結構,是地球上最常見的物質之一,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分,故甲為水,乙為正四面體結構,無色無味而易燃,是21世紀的主要能源,乙為甲烷,丙分子有3個不同的原子,至少還有C、H、O中的兩種,且有強氧化性,可以用于消毒殺菌,丙應是HClO,再根據信息①原子半徑大小:A>B>C>D可得,A為Cl元素、B為C元素、C為O元素、D為H元素,
(1)根據上面的分析可知,甲、乙、丙中含有共同元素是氫元素,
故答案為:氫;
(2)B為碳元素,在周期表中第二周期第IVA族,
故答案為:第二周期第IVA族;
(3)上述元素的原子M層有一個未成對p電子的是氯元素,
故答案為:Cl;
(4)丙為次氯酸,它的電子式為![]() ,次氯酸與SO2水溶液可發生氧化還原反應,生成兩種強酸,反應方程式為HClO+H2O+SO2=H2SO4+HCl,
,次氯酸與SO2水溶液可發生氧化還原反應,生成兩種強酸,反應方程式為HClO+H2O+SO2=H2SO4+HCl,
故答案為:![]() ;HClO+H2O+SO2=H2SO4+HCl.
;HClO+H2O+SO2=H2SO4+HCl.
【題型】推斷題
【結束】
19
【題目】現有部分前36號元素的性質或原子結構如下表
| 元素編號 | 元素性質或原子結構 |
R | 基態原子的最外層有3個未成對電子,次外層有2個電子 |
S | 單質能與水劇烈反應,所得溶液呈弱酸性 |
T | 基態原子3d軌道上有1個電子 |
X | |
(1)R元素的第一電離能要大于其同周期相鄰的元素,原因是________________________________________________________。
(2)S元素的化合價是否有正價?__________,原因是__________________________________,最外層電子排布式為________________________。
(3)T元素的原子N能層上電子數為__________,其原子結構示意圖為__________。
(4)X的核外電子排布圖違背了__________。用X單質、堿金屬鹽及堿土金屬鹽等可以做成焰火。燃放時,焰火發出五顏六色的光,請用原子結構的知識解釋發光的原因:____________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表給出了五種元素的相關信息,其中X、Y、Z、W為短周期元素。
元素 | 相關信息 |
X | 在常溫、常壓下,其單質是氣體,隨著人類對環境的認識和要求的提高,它將成為備受青睞的清潔燃料 |
Y | 工業上通過分離液態空氣獲得其單質,其某種同素異形體是保護地球地表環境的重要屏障 |
Z | 植物生長三要素之一,它能形成多種氧化物,其中一種是早期醫療中使用的麻醉劑 |
W | 室溫下其單質呈粉末狀固體,加熱易熔化。該單質在氧氣中燃燒,發出明亮的藍紫色火焰 |
M | 它是人體不可缺少的微量元素,其單質也是工業生產中不可缺少的金屬原材料,常用于制造橋梁、樓房等 |
根據上述信息填空:
(1)Y元素的基態原子含有幾個能層:________,其中第二能層中有哪幾個能級:________;畫出W的原子結構示意圖:________。
(2)Z與X形成的某一化合物能和Z與Y形成的另一無色化合物(這兩種化合物分子中原子個數比皆為1:2)一起用作火箭助推劑,寫出兩者發生反應生成無毒物質的化學方程式:_______。
(3)某礦藏主要含W、M兩種元素組成的化合物,它是我國生產某強酸的主要原料。試寫出該生產過程中第一階段主要反應的化學方程式:__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)如下圖所示,左室容積為右室的兩倍,溫度相同,現分別按照如圖所示的量充入氣體,同時加入少量固體催化劑使兩室內氣體充分反應達到平衡,打開活塞,繼續反應再次達到平衡,下列說法正確的是_____

A.第一次平衡時,SO2的物質的量右室更多
B.通入氣體未反應前,左室壓強和右室一樣大
C.第一次平衡時,左室內壓強一定小于右室
D.第二次平衡時,SO2的總物質的量比第一次平衡時左室SO2的物質的量的2倍還要多
(2)NH3合成常見的化肥尿素【化學式為CO(NH2)2】分為三步,其中第一步為:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,對于這個反應,在2L等容密閉容器中充入2molNH3和1molCO2,平衡時放出127.6kJ的熱量,若反應溫度不變,在該容器中充入2.8molNH3和1.4molCO2,到達平衡時,c(NH3)為___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,對于這個反應,在2L等容密閉容器中充入2molNH3和1molCO2,平衡時放出127.6kJ的熱量,若反應溫度不變,在該容器中充入2.8molNH3和1.4molCO2,到達平衡時,c(NH3)為___________。
(3)①室溫下,在0.5mol/L純堿溶液中加入少量水,由水電離出的c(H+)×c(OH-)_________。(填“變大”、“變小”、“不變”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等體積的0.00008mol/LK2CrO4溶液,則溶液中的c(CrO42-)=___________。
③室溫下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一種可充電電池Na—Al/FeS,電池工作時Na+的物質的量保持不變,并且是用含Na+的導電固體作為電解質,已知該電池正極反應式為2Na++FeS+2e—=Na2S+Fe,則該電池在充電時,陽極發生反應的物質是____________,放電時負極反應式為__________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com