
Ba(OH)2(固體)、CuSO4(固體)、CH3COOH(液態)這些物質為什么歸為一類,下列哪些物質還可以和它們歸為一類 ( )
A. 75%的酒精溶液 B. 硝酸鈉 C. Fe(OH)3膠體 D. 豆漿
科目:高中化學 來源:2016-2017學年浙江省臺州市高一上學期期末質量評估考試化學試卷(解析版) 題型:選擇題
下列物質間的轉化,能通過一步反應實現的是
A. S→SO3 B. Fe→FeCl2 C. CuO→Cu(OH)2 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省高二下學期開學考試化學試卷(解析版) 題型:選擇題
某溶液中含有兩種溶質NaCl和H2SO4,它們的物質的量之比為3∶1。滴入幾滴石蕊溶液后,用石墨作電極電解該混合溶液,根據電極產物,電解過程可明顯分為三個階段。下列敘述中,不正確的是
A. 陰極自始至終只產生H2
B. 電解過程中,溶液顏色呈現紅色→紫色→藍色的變化
C. 電解過程中,Na+和SO2- 4的物質的量濃度保持不變
D. 第一階段中陰、陽兩極產生的氣體混合引燃后,恰好完全反應得到HCl
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一下學期第一次模塊考試化學試卷(解析版) 題型:實驗題
某同學按下列步驟配制500 mL 0.20 mol·L-1KCl溶液,請回答有關問題。
實驗步驟 | 有關問題 |
(1)計算所需KCl的質量 |
|
(2)稱量KCl固體 | 稱量過程中主要用到的儀器是__________ |
(3)將KCl加入100 mL燒杯中,加適量蒸餾水溶解 |
|
(4)將燒杯中的溶液轉移至500 mL容量瓶中,洗滌2至3次并將洗滌液轉入容量瓶中 | 為防止溶液濺出,應該采取的措施是______________________________ |
(5)向容量瓶中加蒸餾水至刻度線 | 在進行此操作時應注意的問題是______________________________ |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一下學期第一次模塊考試化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A. CO2的摩爾質量為44g
B. 5.4mL4℃的H2O中有1.806×1023個分子
C. 標準狀況下,2.24L CCl4所含的原子數為0.5NA
D. 50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物質的量之和是0.1mol
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省大連市高二上學期期末考試(理)化學試卷(解析版) 題型:簡答題
(1)硝化法是一種古老的生產硫酸的方法,同時實現了氮氧化物的循環轉化,主要反應為:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某溫度下,NO2(g)+SO2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1,某溫度下,NO2(g)+SO2(g) SO3(g)+NO(g)的平衡常數K=
SO3(g)+NO(g)的平衡常數K=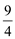 ,該溫度下在甲、乙、丙三個體積為2L的恒容密閉容器中,投入NO2(g)和SO2(g),其起始濃度如下表所示:
,該溫度下在甲、乙、丙三個體積為2L的恒容密閉容器中,投入NO2(g)和SO2(g),其起始濃度如下表所示:
起始濃度 | 甲 | 乙 | 丙 |
c(NO2)/mol·L-1 | 0.10 | 0.20 | 0.20 |
c(SO2)/mol·L-1 | 0.10 | 0.10 | 0.20 |
①10 min后,甲中達到平衡,則甲中反應的平均速率v(NO2)=___________。
②丙達到平衡所用的時間_______10 min(填“<”、“>”、“=”),達到平衡后,設甲、乙、丙中SO2(g)的轉化率分別為a、b、c,則三者的大小關系為_______________。
(2)研究鐵及其化合物對生產生活具有重要的意義。一定條件下鐵可以和CO2發生反應:Fe(s)+CO2(g) FeO(s)+CO(g),已知該反應的平衡常數(K)與溫度(T)的關系如圖甲所示:
FeO(s)+CO(g),已知該反應的平衡常數(K)與溫度(T)的關系如圖甲所示:
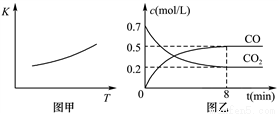
①反應ΔH__________0(填“<”或“>”)。
②下列措施中能使平衡時c(CO)/c(CO2)增大的是__________(填序號)。
A.升高溫度 B.增大壓強
C.充入一定量CO D.再加入一些鐵粉
③一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,反應過程中CO2氣體和CO氣體的濃度與時間的關系如圖乙所示。計算該反應的平衡常數K=_______。
(3)已知:CO(g)+2H2(g)=CH3OH (g) ΔH=-116 kJ·mol-1;
CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1;
H2 (g)+1/2O2(g)=H2O(g) ΔH=-242 kJ·mol-1 ;
寫出CH3OH燃燒生成CO2和水蒸氣的熱化學方程式_____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省大連市高二上學期期末考試(理)化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、Na+、SO42-
B. c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、Cl-、NO3-
C. 水電離出的c(H+)=10-12 mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D. c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化學 來源:2017屆重慶市高三適應性月考(五)理綜化學試卷(解析版) 題型:推斷題
(1)六種元素中第一電離能最小的是_____________(填元素符號,下同)
(2)黃血鹽是由A、B、C、D四種元素形成的配位化合物C4[D(AB)6],易溶于水,廣泛用作食鹽添加劑(抗結劑)。請寫出黃血鹽的化學式___ _,1molAB一中含有π鍵的數目為__ ______(阿伏加德羅常數的值為NA),黃血鹽晶體中各種微粒間的作用力不涉及____ (填序號)。
a .金屬鍵. b.共價鍵 c.配位鍵 d.離子鍵 e.氫鍵 f.分子間的作用力
(3)E2+的價層電子排布圖為 ,很多不飽和有機物在E催化下可與H2發生加成反應:如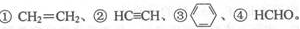 其中碳原子采取sp2雜化的分子有 (填物質序號),HCHO分子的立體結構為 ,它加成后產物甲醇的熔、沸點比CH4的熔、沸點高,其主要原因是 。
其中碳原子采取sp2雜化的分子有 (填物質序號),HCHO分子的立體結構為 ,它加成后產物甲醇的熔、沸點比CH4的熔、沸點高,其主要原因是 。
(4)金屬C、F晶體的晶胞結構如圖(請先判斷對應的圖),C、F兩種晶體晶胞中金屬原子的配位數之比為_ ___ 。金屬C的晶胞中,若設該晶胞的密度為ag/cm3,阿伏加德羅常數的值為NA,C原子的摩爾質量為M g/mol,則表示C原子半徑的計算式為 cm(不必化簡)。
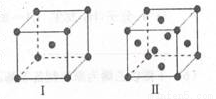
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省衡陽市高三第二次質檢化學試卷(解析版) 題型:選擇題
設NA表示阿伏加德羅常數的值。下列敘述正確的是
A. 1.00mol NaCl中含有NA個NaCl 分子
B. 常溫常壓下,22.4LCl2與足量鎂粉反應,轉移的電子數為2NA
C. 一定條件下,2.3gNa與足量O2完全反應生成3.6g產物時失去的電子數為0.1NA
D. 28g乙烯和環丙烷(C3H6)組成的混合氣體中含有氫原子的個數為3 NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com