
【題目】NaCl是一種基礎化工原料,通過電解飽和食鹽水可以制得NaOH、H2、Cl2。
完成下列填空:
(1)寫出電解飽和食鹽水的化學方程式_____________________。
(2)氯原子的最外層電子排布式為_______,氯離子核外有_____種運動狀態不同的電子。
(3)氯氣壓縮成為液氯屬于________變化(選填“物理”“化學”)。常用濃氨水來檢查輸氯管道是否泄漏,泄漏處會觀察到大量的白煙(NH4Cl),還生成一種無色無味的單質氣體,寫出此反應的化學方程式并標出電子轉移的方向和數目__________________。
(4)氯氣可用來標定碘水中碘單質的含量:5Cl2+I2+6H2O→10HCl+2HIO3。測定時可用氣體流量計準確控制氯氣的體積,以淀粉做指示劑來指示反應終點,反應終點時的現象是___________________。
用氯氣標定一定體積碘水中碘單質的濃度,進行三次平行實驗,數據記錄見下表:
碘水的體積(mL) | 標況下氯氣的體積(mL) |
500 | 56 |
500 | 55 |
500 | 57 |
則上述碘水中碘單質的濃度為____mol/L,假定碘水的實際濃度為1.02×10-3mol/L,則實驗的相對誤差為_______(保留兩位小數)。
【答案】 2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑ 3s23p5 18 物理
2NaOH + H2↑ + Cl2↑ 3s23p5 18 物理 ![]() 溶液由藍色逐漸變為無色,且在半分鐘內不變色 1 × 10-3 mol/L -1.96%
溶液由藍色逐漸變為無色,且在半分鐘內不變色 1 × 10-3 mol/L -1.96%
【解析】(1)電解飽和食鹽水生成氫氧化鈉、氫氣和氯氣,反應的化學方程式為2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑,故答案為:2NaCl + 2H2O
2NaOH + H2↑ + Cl2↑,故答案為:2NaCl + 2H2O ![]() 2NaOH + H2↑ + Cl2↑;
2NaOH + H2↑ + Cl2↑;
(2)氯是17號元素,原子的最外層電子排布式為3s23p5,氯離子核外有18種運動狀態不同的電子,故答案為:3s23p5;18;
(3)氯氣壓縮成為液氯是狀態的變化,屬于物理變化;濃氨水來檢查輸氯管道是否泄漏,泄漏處會觀察到大量的白煙(NH4Cl),還生成一種無色無味的單質氣體為氮氣,反應的化學方程式和電子轉移的方向和數目表示為![]() ,故答案為:物理;
,故答案為:物理;![]() ;
;
(4)根據5Cl2 + I2 + 6H2O → 10HCl + 2HIO3,以淀粉做指示劑來指示反應終點,反應終點時溶液由藍色逐漸變為無色,且在半分鐘內不變色;三次的平均體積為56 mL,根據5Cl2 + I2 + 6H2O → 10HCl + 2HIO3,n(I2)= ![]() n(Cl2)=
n(Cl2)= ![]() ×
×![]() =5×10-4mol,c(I2)=
=5×10-4mol,c(I2)= ![]() = 1 × 10-3 mol/L,實驗的相對誤差=
= 1 × 10-3 mol/L,實驗的相對誤差=![]() ×100%= -1.96%,故答案為:溶液由藍色逐漸變為無色,且在半分鐘內不變色;1 × 10-3 mol/L; -1.96%。
×100%= -1.96%,故答案為:溶液由藍色逐漸變為無色,且在半分鐘內不變色;1 × 10-3 mol/L; -1.96%。


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】廢棄物的綜合利用既有利于節約資源,又有利于保護環境。實驗室利用廢舊黃銅(Cu、Zn合金,含少量雜質Fe)制備膽礬晶體(CuSO4·5H2O)及副產物ZnO。制備流程圖如下:

已知:Zn及化合物的性質與Al及化合物的性質相似,Zn(OH)2能溶于NaOH溶液。下表列出了幾種離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1.0mol·L-1計算)。
Fe3+ | Fe2+ | Zn2+ | |
開始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
請回答下列問題:
(1)實驗中的過濾操作所用到的玻璃儀器為____________________。
(2)加入ZnO調節pH=a的目的是____________________,a的范圍是___________。
(3)由不溶物E生成溶液D的化學方程式為______________________________。
(4)由溶液D制膽礬晶體包含的主要操作步驟是___________,__________,過濾。
(5)若在濾液C中逐滴加入鹽酸直到過量,則產生的現象是______________________。
(6)若廢舊黃銅的質量為a g,最終得到的膽礬晶體為b g,則該黃銅中銅元素的質量分數為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組探究少量Cl2和FeBr2反應的過程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黃色。取少量此溶液,向其中滴入KSCN溶液,變為淺紅色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黃色的原因是其中含有________,用離子方程式解釋產生其原因:_______。
(2)氯氣和FeBr2反應實驗操作及現象如下:

據此甲同學得出結論:少量Cl2既能和Fe2+又能和Br-發生氧化還原反應。
①Cl2和Fe2+發生反應的離子方程式是________________。
②乙同學認為上述實驗不能證明Cl2和Br-發生反應,理由是_____________。
③乙同學改進實驗如下:在上述FeBr2溶液中加入過量鐵粉,取上清液2 mL,向其中滴加3滴飽和氯水后,再加入CCl4,振蕩后靜置,觀察現象。乙得出結論:少量Cl2只與Fe2+反應,不與Br-反應。乙得出該結論依據的實驗現象是____________________。
(3)丙同學繼續設計實驗,探究反應過程:

①轉移到大試管前CCl4液體中呈紅棕色的物質是___________。
②丙通過此實驗可得出結論:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、G五種元素分屬三個短周期,且原子序數依次增大。X、Z同主族,可形成離子化合物ZX;Y、M同主族,對形成MY2、MY3兩種分子。
請回答下列問題:
(1)Y在元素周期表中的位置為____________。
(2)上述元素最高價氧化物對應的水化物酸性最強的是_______(寫化學式),非金屬氣態氫化物還原性最強的是___________(寫化學式)。
(3)Y、G的單質或兩元素之間形成的化合物可作水消毒劑的有_______(寫出其中兩種物質的化學式)。
(4)ZX的電子式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在一個2L的密閉容器中,X、Y、Z三氣體種物質的物質的量隨時間的變化曲線如圖所示,據此回答:

(1)該反應的化學方程式為___________
(2)從開始至2min,X的平均反應速率為________mol/(L·min)
(3)改變下列條件,可以加快化學反應速率的有_________
A.升高溫度 B.減小物質X的物質的量 C.增加物質Z的物質的量. D.減小壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的工業制法中,不正確的是:
A. 制鈉:用海水為原料制得精鹽,再電解純凈的NaCl溶液
B. 制鎂:用海水為原料,經一系列過程制得氯化鎂固體,電解熔融的氯化鎂得鎂
C. 制鐵:以鐵礦石為原料,CO還原得鐵
D. 制漂白粉:將氯氣通入石灰乳中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的離子,能在溶液中大量共存的是
A. K+、Mg2+、NO3-、Cl- B. Ba2+、Na+、CO32-、 OH-
C. Mg2+、Ba2+、OH-、NO3- D. H+、 K+、 CO32-、 SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些有機化合物之間具有如下轉化關系:
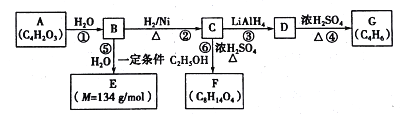
其中A是一種五元環狀化合物,其分子中只有一種化學環境的氫原子;F核磁共振氫譜顯示有三種化學環境的氫原子,且峰面積之比為2:2:3。
已知:①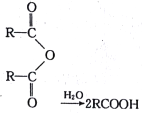 (其中R是烴基)
(其中R是烴基)
②R-COOH![]() R-CH2OH(其中R是烴基)
R-CH2OH(其中R是烴基)
請回答下列問題:
(1)B中含氧官能團的名稱是______,G是合成順丁橡膠的主要原料,G的名稱是_____,③的反應類型是________。
(2)寫出A的結構筒式____________。
(3)寫出⑥的化學方程式__________________。
(4)E在一定條件下能夠發生縮聚反應,其中主鏈上含“-CH2-”的聚物的結構簡式為_____。有機物Y與E互為同分異構體,且具有相同的官能團種類和數目,則Y的結構可有____種。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com