
【題目】下列金屬或氧化物可以完全溶解的是
A、1molZn與含1molHCl的稀鹽酸共熱
B、1molCu與含2molH2SO4的濃硫酸共熱
C、1molCu與含4molHNO3的濃硝酸
D、1molMnO2與含4molHCl的濃鹽酸共熱
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】重金屬元素鉻的毒性較大,含鉻廢水需經處理達標后才能排放。
(Ⅰ)某工業廢水中主要含有Cr3+,同時還含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性較強。為回收利用,通常采用如下流程處理:
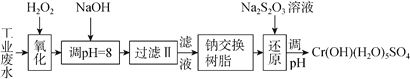
注:部分陽離子常溫下以氫氧化物形式完全沉淀時溶液的pH見下表。
氫氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化過程中可代替H2O2加入的試劑是________(填序號)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液調整溶液pH=8時,除去的離子是___(填序號);已知鈉離子交換樹脂的原理:Mn++nNaRMRn+nNa+,此步操作被交換除去的雜質離子___(填序號)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)在還原過程中,每消耗172.8gCr2O72- 轉移4.8mole-,則還原過程中該反應離子方程式為____。(已知在氧化過程中Cr3+轉化為Cr2O72- )
(Ⅱ)酸性條件下,鉻元素主要以Cr2O72-形式存在,工業上常用電解法處理含Cr2O72-的廢水。實驗室利用如圖裝置模擬處理該廢水,陽極反應是Fe-2e-![]() Fe2+,陰極反應式是2H++2e-
Fe2+,陰極反應式是2H++2e-![]() H2↑。
H2↑。
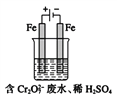
(1)電解時能否用Cu電極來代替Fe電極?______(填“能”或“不能”),理由是_____。
(2)電解時陽極附近溶液中轉化為Cr3+的離子方程式為___________________。
(3)上述反應得到的金屬陽離子在陰極區可沉淀完全,從其對水的電離平衡影響角度解釋其原因______________________。
(4)若溶液中初始含有0.1mol Cr2O72-,則生成的陽離子全部轉化成沉淀的質量是_______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同溫、同壓下等質量的SO2氣體和CO2氣體,下列有關比較的敘述中,正確的是①密度比為16:11 ②密度比為11:16 ③體積比為16:11 ④體積比為11:16( )
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據元素周期表和元素周期律,判斷下列敘述不正確的是
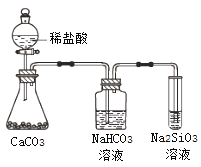
A. 氣態氫化物的穩定性:H2O>NH3>SiH4
B. 氫元素與其他元素可形成共價化合物或離子化合物
C. 上圖所示實驗可證明元素的非金屬性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118號元素在周期表中位于第七周期0族
”(ào)命名的第118號元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F是前四周期原子序數依次增大的六種元素。A元素原子的核外電子數等于其電子層數,B元素基態原子有三個能級且各能級電子數相同,A與D可形成兩種常見液態化合物G、H,其原子數之比分別為1:1和2:1,E元素原子的K、L層電子數之和等于其M、N層電子數之和,F被稱為繼鐵、鋁之后的第三金屬,具有良好的生物親和性,還可用于制造飛機、火箭、人造衛星、宇宙飛船等領域,F4+和氬原子的核外電子排布相同。請回答下列各題(涉及元素請用相應化學符號表示):
(1)B、C、D中電負性最大的元素其基態原子有________種不同能量的電子。
(2)G分子中D原子的雜化方式為_____________,F2+的基態價電子排布式為____________。
(3)BA3- 離子的空間構型為________,與其互為等電子體的一種陽離子的電子式為____________。
(4)某化合物晶胞結構如右圖所示,E2+的最近且等距的D2-有_________個。KIO3晶體是一種性能良好的非線性光學材料,具有與右圖相似的立體結構,邊長為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,K與O間的最短距離為______nm。

(5)用高能射線照射液態H時,一個H分子能釋放出一個電子,同時產生一種陽離子。釋放出來的電子可以被若干H分子形成的“網”捕獲,你認為H分子間能形成“網”的原因________________。且由H分子釋放出電子時產生的該種陽離子具有較強的氧化性,試寫出該陽離子與S02的水溶液反應離子方程式______________________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、P、Q為五種短周期元素,其原子半徑和最外層電子數之間的關系如下圖所示。下列說法正確的是

A. Q的氧化物一定含有離子鍵和共價鍵 B. 最高價含氧酸的酸性:Z<Y
C. P的最低價氫化物常溫常壓下為液體 D. Y形成的化合物種類最多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,將H2和N2置于一容積為2 L的密閉容器中發生反應。反應過程中H2、N2和NH3的物質的量變化如下圖:
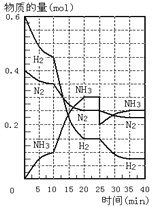
(1)計算反應開始10分鐘內,NH3的平均反應速率___________
(2)反應處于平衡狀態的時間是:__________________________
(3)圖中10~20分鐘曲線發生變化的可能原因是_______________。
(4)第25分鐘,平衡改變的條件是____________________,此時正反應速率_____(填增大、減小或不變),重新達平衡后,NH3的體積分數比原平衡______(填大、小或不變)。
(5)判斷該反應達到平衡狀態的標志是_________________________(填字母);
a.N2和NH3濃度相等 b.NH3百分含量保持不變
c.容器中氣體的壓強不變 d.NH3的生成速率與H2的消耗速率相等
e.容器中混合氣體的密度保持不變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com