
將V mL NO和NO2的混合氣體通過足量水吸收后,得到a mL無色氣體A,將A氣體與等體積O2混合,再通過水充分吸收后,收集到5 mL無色氣體B。試通過計算回答:
(1)A、B各為何種氣體?
(2)A氣體的體積是多少?
(3)V的取值范圍是多少?
(1)A、B分別為NO、O2 (2)20 mL (3)(5,15)
因為3NO2+H2O====2HNO3+NO
所以a mL無色氣體為NO
將NO氣體與氧氣等體積混合,通過水發生的反應為:4NO+3O2+2H2O====4HNO3,由于氧氣過量,所以收集到的5 mL無色氣體B是氧氣
4NO + 3O2+2H2O====4HNO3
4 mL 3 mL
V(NO) V(NO)-5 mL
V(NO)=20 mL
若V mL氣體全部是NO時,V=5,由于是兩種氣體的混合氣體,故V的取值大于5。
若VmL氣體全部是NO2時
3NO2+H2O====2HNO3+NO
3 mL 1 mL
VmL 5 mL
V=15
由于是兩種氣體的混合氣體,故V的取值小于15。


科目:高中化學 來源:2012-2013學年四川省成都外國語學校高一下學期期中考試化學試卷(帶解析) 題型:填空題
(I)(10分)某自主學習小組用HNO3與大理石反應過程中質量減小的方法,探究影響反應速率的因素。所用HNO3濃度為1.00 mol·L-1、2.00 mol·L-1,大理石有細顆粒與粗顆粒兩種規格,實驗溫度為298 K、308 K,每次實驗HNO3的用量為25.0 mL,大理石用量為10.00g。請完成以下實驗設計表,并在實驗目的一欄中填出對應的實驗編號:
| 實驗編號 | T/K | 大理石規格 | HNO3濃度/mol·L-1 | 實驗目的 |
| ① | 298 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究HNO3濃度對該反應速率的影響; (Ⅱ)實驗①和__探究溫度對該反應速率的影響; (Ⅲ)實驗①和__探究大理石規格(粗、細)對該反應速率的影響。 |
| ② | | | | |
| ③ | | 粗顆粒 | | |
| ④ | | | |
 2NO2(g),正反應放熱。測得n(NO)隨時間的變化如下表,請回答:
2NO2(g),正反應放熱。測得n(NO)隨時間的變化如下表,請回答:| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市松江區高三上學期期末(一模)考試化學試卷(解析版) 題型:填空題
綠礬(FeSO4·7H2O)在化學合成上用作還原劑及催化劑,工業上常用廢鐵屑溶于一定濃度的硫酸溶液制備綠礬。
(1)98% 1.84 g/cm3的濃硫酸在稀釋過程中,密度下降,當稀釋至50%時,密度為1.4g/cm3,50%的硫酸物質的量濃度為 (保留兩位小數),50%的硫酸與30%的硫酸等體積混合,混合酸的濃度為 (填>、<、=)40%。
(2)實際生產用20%發煙硫酸(100克發煙硫酸含SO3 20克)配制稀硫酸,若用SO3·nH2O表示20%的發煙硫酸,則n=____________(保留兩位小數)。
(3)綠礬在空氣中容易被部分氧化為硫酸鐵,現取7.32克晶體溶于稀鹽酸后,加入足量的BaCl2溶液,過濾得沉淀9.32克;再通入112mL(標準狀況)氯氣恰好將Fe2+完全氧化,推測晶體的化學式為 。
(4)硫酸亞鐵銨[(NH4)2SO4·FeSO4·6H2O](俗稱莫爾鹽),較綠礬穩定,在分析化學中常用來配制Fe2+的標準溶液,用此Fe2+的標準溶液可以測定剩余稀硝酸的量。現取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液處理,發生反應如下:
10NO3-+3Cu2S+16H+→6Cu2++10NO↑+3SO42-+8H2O
8NO3-+3CuS+8H+→ 3Cu2++3 SO42-+8NO↑+ 4H2O
剩余的稀硝酸恰好與V mL 2 mol/L (NH4)2Fe(SO4)2溶液完全反應。
已知:NO3-+3Fe2++4H+→ NO↑+3Fe3++2H2O
① V值范圍 ;
② 若V=48,試計算混合物中CuS的質量分數(保留兩位小數)。
查看答案和解析>>
科目:高中化學 來源:2015屆四川省成都外國語學校高一下學期期中考試化學試卷(解析版) 題型:填空題
(I)(10分)某自主學習小組用HNO3與大理石反應過程中質量減小的方法,探究影響反應速率的因素。所用HNO3濃度為1.00 mol·L-1、2.00 mol·L-1,大理石有細顆粒與粗顆粒兩種規格,實驗溫度為298 K、308 K,每次實驗HNO3的用量為25.0 mL,大理石用量為10.00g。請完成以下實驗設計表,并在實驗目的一欄中填出對應的實驗編號:
|
實驗編號 |
T/K |
大理石規格 |
HNO3濃度/mol·L-1 |
實驗目的 |
|
① |
298 |
粗顆粒 |
2.00 |
(Ⅰ)實驗①和②探究HNO3濃度對該反應速率的影響; (Ⅱ)實驗①和__探究溫度對該反應速率的影響; (Ⅲ)實驗①和__探究大理石規格(粗、細)對該反應速率的影響。 |
|
② |
|
|
|
|
|
③ |
|
粗顆粒 |
|
|
|
④ |
|
|
|
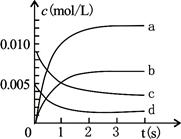
(II)(5分) 800℃時在2 L密閉容器內加入NO和O2,發生反應:2NO(g)+O2(g) 2NO2(g),正反應放熱。測得n(NO)隨時間的變化如下表,請回答:
2NO2(g),正反應放熱。測得n(NO)隨時間的變化如下表,請回答:
|
時間/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡濃度c(NO)= ;
(2)用O2表示從0~2s內該反應的平均反應速率為 ;
(3)右圖中表示NO2變化的曲線是 ;

(4)在其他條件不變,5min時分別改變下列條件,將改變條件后反應速率的變化情況(“增大”、“減小”或“不變”)填入空格內:①升溫 V ②體積不變充入He氣體 V
查看答案和解析>>
科目:高中化學 來源:專項題 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:
常溫下,將m mL NO2和NO混合氣通入過量飽和NaHCO3溶液中,再使逸出的氣體通過裝有Na2O2(過量)的干燥管,最后收集到n mL b氣體,據NO2和NO的體積比推斷b的成分,正確的是 ( )
A.當V(NO2):V(NO)=3:1時,b為NO2
B.當V(NO2):V(NO)<3:1時,b為O2
C.當V(NO2):V(NO)>3:1時,b為NO和NO2
D.當V(NO2):V(NO)=3:1時,b為NO2和O2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com